ЗАНЯТИЕ №
Тема: Устойчивость коллоидных систем. Коагуляция.
Мотивация изучения темы: Для биологов и медиков представляет большой интерес изучение процессов коагуляции и пептизации. Коагуляция растворов фосфата кальция и холестерина в крови приводит к образованию и отложению осадков на внутренней поверхности кровеносных сосудов. Свертывание крови, слипание эритроцитов в так называемые «монетные столбики» представляют собой процессы, аналогичные коагуляции. В основе процесса растворения тромбов лежит пептизация.
При введении смеси солей следует предварительно убедиться, что эти соли не являются синергистами, чтобы избежать коагуляции. Решение многих проблем в медицине связано с проблемами свертывания крови. В хирургии во время операции в кровь вводят антикоагулянты (гепарин), а после операции – для повышения коагуляции – протамин-сульфат.
С явлением коагуляции эритроцитов вследствие уменьшения их дзета-потенциала врачи постоянно имеют дело в клинических лабораториях (метод определения СОЭ – скорости оседания эритроцитов). Это явление объясняется тем, что при патологии в крови увеличивается содержание некоторых видов белков, место ионов электролитов на поверхности эритроцитов занимают белки, заряд которых ниже, чем у суммы замещенных ими ионов. Заряд эритроцитов понижается, они быстрее объединяются и оседают.
В гигиене и санитарии применяют коагуляцию для очистки питьевых и сточных вод. В санитарном деле очистка питьевой воды основана на процессах адсорбции и взаимной коагуляции.
Цель: Приобрести навыки измерения (определения) порогов коагуляции золей и коагулирующей способности электролитов, определения знака заряда коллоидных частиц.
Задачи изучения:
1. Знать строение мицелл.
2. Знать виды устойчивости коллоидных растворов, их причину и факторы, вызывающие ее нарушении; явление коллоидной защиты.
Продолжительность занятия - 165 минут (135 учебного времени и 30мин перерыв).![]()
![]()
Место проведения занятия - учебный практикум (кафедра общей химии)
Задания для самостоятельной работы студента во внеучебное время (самоподготовка).
А. Контрольные вопросы
1. Устойчивость дисперсных систем (понятие). Виды устойчивости: кинетическая (седиментационная), агрегативная, конденсационная.
2. Коагуляция. Факторы, влияющие на процесс коагуляции коллоидных растворов. Стадии процесса коагуляции: скрытая и явная.
3. Влияние электролитов на процесс коагуляции коллоидных частиц. Порог коагуляции. Правило Шульце-Гарди.
4. Коагуляция смесями электролитов: аддитивность, синергизм, антагонизм. Взаимная коагуляция.
5. Пептизация.
6. Коллоидная защита, ее значение.
Б. Список рекомендуемой литературы:
1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для ВУЗов/ , , и др. - 2 изд. - М.: ВШ, 2000.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов./под ред. , - М.: ВШ, 2006.
3. , , Филиппова задач и упражнений по общей химии. - М.: ВШ, 2007.
4. Практикум по общей и биоорганической химии /под ред. – 3-е изд.-М.: изд. центр «Академия», 2008.-240с
В. Обучающий материал.
Коагуляция (от лат. coagulatio – свертывание, сгущение) – потеря коллоидными системами агрегативной устойчивости. Коагуляция коллоидных растворов может быть вызвана воздействием различных факторов: концентрированием дисперсной фазы, диализом, механическим воздействием, изменением температуры, различными видами излучений, добавлением электролитов.
Наибольшее теоретическое и практическое значение имеет разрушение золя при добавлении электролита. Минимальная концентрация электролита, по достижении которой начинается коагуляция, называется порогом коагуляции.
![]()
где V0 – объем золя, л; Vmin – минимальный объем раствора электролита, вызывающий коагуляцию золя, л; С – концентрация электролита в растворе, моль/л. Величина, обратная, порогу коагуляции, называется коагулирующей способностью: КС = 1/Спор
Коагулирующее действие электролитов подчиняется правилу Шульце-Гарди: коагуляцию вызывают ионы с зарядом, противоположным заряду гранулы, и коагулирующая способность тем выше, чем выше заряд коагулирующего иона. Правило Шульце-Гарди носит приближенный характер, т. к. наряду с величиной заряда имеет значение и природа ионов: чем выше гидратируемость иона, тем меньше его коагулирующая способность.
По уменьшению степени гидратации ионы могут быть расположены в следующие ряды (лиотропные ряды Гофмейстера)
C2O42->SO42->CH3COO->Cl->NO3->Br->I->CNS-
Li+>Na+>K+>Rb+>Cs+>Mg2+>Ca2+>Sr2+>Ba2+
Коагулирующее действие ионов вязано с уменьшением дзета-потенциала коллоидных частиц за счет сжатия диффузного слоя и за счет избирательной и ионообменной адсорбции на коллоидных частицах ионов электролита с зарядом, противоположным заряду гранулы.
Коагуляция происходит при смешении двух золей с противоположными знаками заряда гранул, такая коагуляция называется взаимной коагуляцией. Разноименно заряженные коллоиды вызывают коагуляцию друг друга только в том случае, когда суммарный заряд частиц одного золя нейтрализует суммарный заряд другого.
Пример. Коллоидный раствор гидроксида железа (III)получен по реакции:
FeCl3 + 3NaOH = Fe(OH)3(тв.) + 3NaCl
При некотором избытке а) FeCl3, б) NaOH. Составьте схему строения мицеллы золя гидроксида железа (III) для случая а) и б). Определите знак заряда коллоидных частиц.
Решение. а) FeCl3→ Fe3+ + 3Cl-
стабилизатор
{m[Fe(OH)3]nFe3+3(n-x)Cl-}3x+ 3xCl-
Знак заряда гранулы положительный.
б) NaOH→Na+ + OH-
{m[Fe(OH)3]nOH - (n-x)Na+}x - xNa+
Знак заряда коллоидных частиц отрицательный.
При смешении двух золей Fe(OH)3 с различными знаками заряда гранул происходит взаимная коагуляция.
Пептизацией называют процесс перехода свежеполученного при коагуляции осадка в золь под действием веществ, называемых пептизаторами. Пептизацию можно вызвать отмыванием коагулята водой от электролита, вызвавшего коагуляцию золя. Пептизация поверхностно-активными веществами связана с тем, что дифильные молекулы ПАВ адсорбируются на частицах осадка, повышая сродство дисперсной фазы к дисперсионной среде. Чаще всего пептизацию вызывают добавлением веществ, которые способны восстановить утраченный заряд коллоидных частиц. Различают адсорбционную и химическую (диссолюционную) пептизацию. Примером адсорбционной пептизации может служить переход в золь свежеполученного и промытого водой осадка гидроксида железа (III) при добавлении к нему небольших количеств раствора хлорида железа (III), которые сообщают частицам положительный заряд:
{m[Fe(OH)3]nFe3+3(n-x)Cl-}3x+3xCl-
Механизм химической пептизации состоит в том, что при добавлении электролита происходит его взаимодействие с частицами осадка, в результате которого образуется пептизатор. Его ионы адсорбируются на частицах осадка, сообщая им заряд. Примером является переход в золь осадка Fe(OН)3 при добавлении небольших объемов HCl, который сам не является стабилизатором, но химически взаимодействует с поверхностью осадка с образованием собственно пептизатора FeOCl
Fe(OH)3 + HCl = FeOCl + 2H2O
FeOCl→ FeO+ + Cl-
Строение мицеллы образующегося зол может быть представлено следующим образом:
{m[Fe(OH)3]nFeО+(n-x)Cl-}x+xCl-
Длительное хранение уменьшает способность осадка к пептизации вследствие рекристаллизации (срастания частиц осадка). Происходит старение осадка.
Г. Обучающие задачи
Определение порога коагуляции по известному количеству электролита, необходимого для добавления к коллоидному раствору.
Задача №1. Коагуляция 10мл гидрозоля железа (III) наступила при добавлении к нему 2 мл раствора сульфата натрия с молярной концентрацией 1,25ммоль/л. Вычислите порог коагуляции и коагулирующую способность электролита.
Решение. Для расчета порога коагуляции воспользуемся формулой:
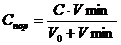 ,
,
Применительно к данной задаче ![]() ;
;
Где С(SO42-) = C(Na2SO42-) = 1,25ммоль/л = 1,25·10-3моль/л
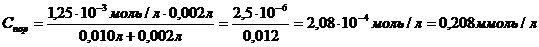 Величину коагулирующей способности вычисляют по формуле:
Величину коагулирующей способности вычисляют по формуле:
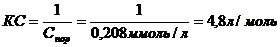
Ответ: Спор=0,208ммоль/л, КС = 4,8л/моль
Определение знака заряда частицы по сопоставлению величин порогов коагуляции данными электролитами.
Задача 2. Коагулирующая способность сульфата натрия по отношению к данному коллоидному раствору выше коагулирующей способности хлорида кальция. По правилу Шульце-Гарди коагулирующая способность электролита тем выше, чем больше заряд коагулирующего иона. У Na2SO4 заряд анионов (SO42-) больше, чему CaCl2 (ионов Cl-), значит, коагулирующими ионами являются анионы. Следовательно, частицы коллоидного раствора заряжены положительно.
Сравнение коагулирующей способности электролитов.
Задача 3. Коллоидный раствор иодида серебра получен по реакции:
KI + AgNO3 = AgI + KNO3
При некотором избытке KI. Его коагулируют растворами сульфата натрия и ацетата кальция. У какого электролита коагулирующая способность выше?
Решение. Т. к. стабилизатором является KI (AgI→ Ag+ + I-), то мицелла имеет строение:
{m[AgI]nI-(n-x)K+}x-xK+
Коллоидная частица (гранула) заряжена отрицательно. Следовательно, коагулирующими ионами являются катионы. Т. к. заряд иона Са2+ больше заряда иона Na+, то коагулирующая способность ацетата кальция выше, чем сульфата натрия.
Выяснение возможности взаимной коагуляции.
Задача 4. Какие золи: гидроксида железа(III) (при избытке FeCl3), иодида серебра (при избытке AgNO3), иодида серебра (при избытке KI), следует смешать, чтобы произошла взаимная коагуляция?
Решение. Взаимная коагуляция возможна при смешивании золей с противоположными знаками заряда гранул. Гранулы золя гидроксида железа (III) заряжены положительно
{m[Fe(OH)3]nFe3+3(n-x)Cl-}3x+
Гранулы золя иодида серебра при избытке AgNO3 (потенциалопределяющие ионы Ag+) заряжены положительно: {m[AgI]nAg+(n-x)NO3-}x, а при избытке KI (потенциал-определяющие ионы I - ) заряжены отрицательно: {m[AgI]nI-(n-x)K+}x-.
Следовательно, взаимная коагуляция возможна при сливании золей а) гидроксида железа(III) и иодида серебра при избытке KI, и б) иодида серебра (при избытке AgNO3) и иодида серебра (при избытке KI).
Д. Задачи для самостоятельного решения.
Задача 1. Коагуляция 1,5мл золя сульфида золота наступила при добавлении к нему 570 мл раствора хлорида натрия концентрацией 0,2моль/л. Вычислите порог коагуляции золя ионами натрия и коагулирующую способность электролита. (Ответ: Спор = 55,0ммоль/л, КС = 0,018л/моль)
Задача 2. Частицы золя при электрофорезе перемещаются к аноду. Коагулирующая способность какого из веществ: Na2SO4, CaCl2 или K3PO4 – будет наибольшей по отношению к данному золю? Дайте пояснения.
Задача 3. Получены два золя иодида серебра из раствора AgNO3 и KI с молярными концентрациями по 0,05моль/л каждый. Один золь получен приливанием раствора AgNO3 объемом 16мл к раствору KI объемом 20мл, другой раствора KI объемом 16мл к раствору AgNO3 объемом 20мл. Будут ли наблюдаться какие-либо явления при смешивании этих золей? Ответ мотивируйте. Напишите формулы мицелл золя.
Задача 4. Золь кадмия сульфида получен смешиванием растворов Na2S и Cd(NO3)2. Пороги коагуляции электролитов к данному золю оказались равными (ммоль/л): Сn(Ca(NO3)2)=265, Cn(NaCl) = 250, Cn(MgCl2) = 290, Cn(Na3PO4) = 0,4, Cn(Na2SO4) = 15, Cn(AlCl3) = 300. Какой из электролитов Na2S или Cd(NO3)2, взят в избытке для получения золя? Составьте схему строения мицеллы золя.



