Кандидат химических наук, доцент
Тема 2. Свойства дисперсных систем,
их устойчивость и коагуляция
Занятие 2. Устойчивость дисперсных систем
Л е к ц и я
Саратов – 2010
СОДЕРЖАНИЕ
Введение
1. Строение коллоидной мицеллы.
2. Физическая теория устойчивости и коагуляции.
3. Основные закономерности коагуляции под действием электролитов.
4. Современные представления о факторах стабилизации коллоидных систем.
Заключение
ЛИТЕРАТУРА
1. Фролов коллоидной химии. М.: Химия, 1989.– С. 375-393.
2. Коллоидная химия. – СПб: «Лань», 2003. – С. 124-160.
НАГЛЯДНЫЕ ПОСОБИЯ И ПРИЛОЖЕНИЯ
1. Слайды № 29, 30:
Строение коллоидной мицеллы.
Расклинивающее действие.
ВВЕДЕНИЕ
Вопрос об устойчивости дисперсных систем – основной при изучении их свойств. Как уже отмечалось, дисперсные системы потому и рассматриваются особо, отдельно от гетерогенных систем, что по внешнему виду они напоминают обычные растворы: прозрачны, внешне однородны, для них характерны диффузия и осмос и т. д. Но в то же время само существование дисперсных систем уже противоречит законам термодинамики: они обладают огромным запасом поверхностной энергии, но, несмотря на это, освобождаются от нее «нехотя». Это явление называется коллоидной устойчивостью.
Коллоидная устойчивость дисперсных систем определяется их способностью сохранять неизменным свой внешний вид: окраску, прозрачность, «однородность».
В практике возникает необходимость как получения дисперсных систем, обладающих высокой устойчивостью, так и разрушения образующихся дисперсных систем там, где это необходимо. Например, аэрозоли, образующиеся при сгорании топлива или дисперсные системы в сточных водах нужно разрушать.
Поэтому необходимо знать основные условия, способствующие сохранению или разрушению дисперсных систем, а для этого необходимо знать строение частиц дисперсной фазы.
Начнем со строения коллоидной частицы.
1. СТРОЕНИЕ КОЛЛОИДНОЙ МИЦЕЛЛЫ
Коллоидная мицелла – это твердая частица дисперсной фазы в жидкой дисперсионной среде. Основываясь на строении ДЭС, можно перейти к рассмотрению строения коллоидных мицелл в целом.
В центре мицеллы находится кристаллическое тело, названное по предложению Пескова агрегатом (рис. 1). На нем, согласно правилу Пескова – Панета – Фаянса, адсорбируются ионы, способные достраивать его кристаллическую решетку. Эти ионы сообщают агрегату электрический заряд и называются потенциалопределяющими. В результате образуется ядро мицеллы, несущее электрический заряд, равный сумме электрических зарядов адсорбировавшихся на агрегате потенциалопределяющих ионов. Ядро создает вокруг себя электрическое поле, под действием которого к нему из раствора притягиваются противоионы. Часть противоионов прочно удерживается ядром благодаря совместному действию электростатических и адсорбционных сил, действующих вблизи ядра. Эти ионы образуют вокруг ядра плотный адсорбционный слой, который прочно удерживается ядром. Ядро совместно с адсорбционным слоем противоионов называют гранулой. Электрический заряд гранулы равен разности электрических зарядов потенциалопределяющих ионов и противоионов адсорбционного слоя. Как правило, гранула имеет такой же заряд, как ядро. Именно заряженная гранула перемещается в электрическом поле. Другая часть противоионов удерживается слабее, только силами электростатического притяжения; из-за явления диффузии эти ионы будут стремиться уйти в глубь жидкости из области с большей концентрацией вблизи гранулы в область с меньшей концентрацией в глубине раствора. Это приводит к тому, что образуется размытый диффузный слой противоионов. Этот слой слабо удерживается коллоидной частицей; в электрическом поле этот слой перемешается в противоположном направлении по сравнению с гранулой. Гранула совместно с диффузным слоем противоионов составляет нейтральную мицеллу.
Рассмотрим строение коллоидной мицеллы на примере золя хлорида серебра AgCl, полученного в результате химической реакции:
AgNO3 + KCl(изб.) ® AgCl¯(тв. ф.) + KNO3
В виде схемы мицеллу изображают следующим образом:
 1 – агрегат;
1 – агрегат;
2 – слой потенциал-
определяющих
ионов;
(1 + 2) – ядро;
3 – адсорбционный
слой
противоионов;
(1 + 2 + 3) – гранула;
4 – диффузный слой
противоионов.
Рис. 1. Схематическое изображение мицеллы
Частицы хлорида серебра AgCl, выпадающие в осадок, образуют основу мицеллы – агрегат. Поскольку в растворе в избытке находится KCl (т. е. ионы K+и Cl–), то на агрегате будут адсорбироваться потенциалопределяющие ионы хлора Cl–, которые способны достраивать кристаллическую решетку AgCl. Образуется отрицательно заряженное ядро мицеллы, к которому из раствора будут притягиваться противоположно заряженные противоионы K+. Противоионы вокруг ядра образуют два слоя: адсорбционный и диффузный. Ядро вместе с адсорбционным слоем образует отрицательно заряженную гранулу. Гранула вместе с диффузным слоем образуют нейтральную мицеллу.
В виде формулы мицеллу изображают следующим образом:
 |

агрегат слой адсорбц. диффузный
потенциалопр. слой слой
ионов противоионов
В электрическом поле гранула мицеллы будет перемещаться к положительно заряженному аноду.
Если осадок AgCl получают в избытке AgNO3, то коллоидная мицелла будет иметь другое строение. На агрегате AgCl будут адсорбироваться потенциалопределяющие ионы Ag+, а противоионами будут являться ионы NO3–.
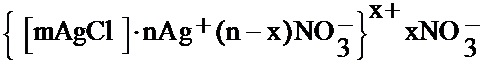
Для нерастворимого в воде сульфата бария (полученного в избытке BaCl2) строение колллоидной частицы можно изобразить формулой:
BaCl2(изб.) + NaSO4 ® BaSO4(тв. ф.) + 2NaCl
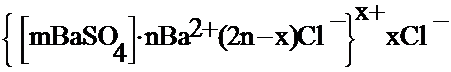
В электрическом поле положительно заряженная гранула будет перемещаться к отицательно заряженному катоду.
2. ФИЗИЧЕСКАЯ ТЕОРИЯ УСТОЙЧИВОСТИ И КОАГУЛЯЦИИ
Коллоидная устойчивость – способность дисперсной системы сохранять неизменным свой состав ( концентрацию дисперсной фазы и распределение частиц по размерам), а также внешний вид: окраску, прозрачность, «однородность».
Следует указать на резкое различие в отношении устойчивости между двумя классами коллоидов: лиофильными и лиофобными. Лиофильные коллоиды обладают высоким сродством к дисперсионной среде, они самопроизвольно диспергируются и образуют термодинамически устойчивые коллоидные растворы. У лиофобных коллоидов степень сродства к растворителю намного меньше, их дисперсии термодинамически неустойчивы и характеризуются высокими значениями поверхностного натяжения на межфазной границе. Именно устойчивость и коагуляцию лиофобных золей мы будем изучать.
Коллоидную устойчивость условно классифицируют на седиментационную (кинетическую) и агрегативную.
Седиментационная устойчивость определяется способностью системы противодействовать оседанию частиц. Седиментация, или оседание частиц, приводит к разрушению дисперсной системы. Дисперсная система считается седиментационно устойчивой, если ее дисперсные частицы не оседают, система не разделяется на фазы, т. е. находится в стабильном диффузионно-седиментационном равновесии.
Седиментационная устойчивость в первую очередь зависит от размеров частиц дисперсной фазы. Если размер их менее 1000 нм, то система обычно обладает высокой седиментационной устойчивостью. В случае более крупных частиц система неустойчива, т. е. со временем расслаивается, частицы дисперсной фазы либо всплывают, либо образуют осадок.
Агрегативная устойчивость определяется способностью дисперсной системы противодействовать слипанию частиц, то есть сохранять неизменными размеры частиц дисперсной фазы. Но из-за стремления систем «избавиться» от свободной энергии (в данном случае – от поверхностной энергии), частицы дисперсной фазы склонны к укрупнению путем их слияния или перекристаллизации.
Под коагуляцией понимают потерю агрегативной устойчивости дисперсной системы, заключающуюся в слипании и слиянии частиц.
Если размеры частиц дисперсной фазы постоянны, не изменяются во времени, то коллоидно-дисперсные системы бесконечно долго могут сохранять седиментационную устойчивость. Укрупнение частиц в дисперсной системе (потеря агрегативной устойчивости) приводит к нарушению седиментационной устойчивости и выпадению осадка.
Количественные соотношения, характеризующие устойчивость лиофобных золей в удовлетворительном согласии с экспериментом, были получены на основе физической теории устойчивости и коагуляции.
Физическая теория устойчивости и коагуляции (ДЛФО)
В наиболее общем виде эта теория была разработана советскими учеными и в г. г., а несколько позднее, независимо от них голландскими учеными Фервеем и Овербеком. По первым буквам фамилий этих ученых теория названа теорией ДЛФО.
В основе теории устойчивости коллоидных систем должно лежать соотношение между силами притяжения и отталкивания частиц. В теории ДЛФО учитывается электростатическое отталкивание между частицами и межмолекулярное притяжение.
Электростатическое отталкивание между одноименно заряженными частицами происходит в том случае, если они подходят друг к другу на достаточно близкое расстояние, их двойные электрические слои перекрываются и отталкиваются.

а) отталкивание отсутствует б) частицы отталкиваются
(ДЭС не перекрываются) (ДЭС перекрываются)
В результате достаточно сложных расчетов (которые мы опускаем) получают выражения для энергии электростатического отталкивания частиц. В соответствии с этим выражением энергия отталкивания частиц возрастает с уменьшением расстояния между ними по экспоненциальному закону
Uэ ~ е –ch,
где Uэ – энергия отталкивания;
c – потенциал на поверхности частиц;
h – расстояние между частицами.
Второй род сил, влияющих на устойчивость золя, – силы притяжения между частицами. Они имеют ту же природу, что и силы, действующие между нейтральными молекулами. Существованием этих сил Ван-дер-Ваальс объяснял свойства реальных газов и жидкостей. Возникновение межмолекулярных сил обусловлено взаимодействием диполей (эффект Кеезона), поляризацией одной молекулы другой (эффект Дебая) и дисперсионными силами Лондона, которые связаны с наличием в нейтральных атомах и молекулах мгновенных диполей.
Наиболее универсальной составляющей молекулярных сил притяжения является дисперсионная составляющая. Расчеты, проведенные Гамакером, привели к следующему выражению для энергии молекулярного притяжения (для параллельных пластин, находящихся на небольших расстояниях друг от друга).
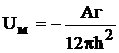 ,
,
где Uм – энергия межмолекулярного притяжения;
Аг – константа Гамакера, которая зависит от природы взаимодейству-ющих фаз;
h – расстояние между пластинами.
Для сферических частиц получается более сложное выражение, однако и для них отрицательная энергия притяжения обратно пропорциональна квадрату расстояния.
В соответствии с теорией ДЛФО соотношение энергий отталкивания и притяжения определяют устойчивость или коагуляцию систем.
Проанализируем, как изменяется энергия взаимодействия в зависимости от расстояния между частицами. Построим графики, характеризующие отдельно энергию притяжения и энергию отталкивания как функции расстояния. Общую энергию взаимодействия можно получить сложением ординат. На рис. 2 показаны такие графики, часто называемые потенциальными кривыми. При их построении придерживаются условия: энергия отталкивания считается положительной, а энергия притяжения - отрицательной. Суммарная энергия взаимодействия двух коллоидных частиц в зависимости от расстояния представлена на рисунке 2. Проанализируем эту кривую. На очень малых расстояниях и больших расстояниях (экспонента убывает значительно быстрее, чем степенная функция) между частицами преобладает энергия притяжения, а на средних расстояниях - энергия электростатического отталкивания.
Первичный минимум I отвечает непосредственному слипанию частиц, а вторичный минимум II их притяжению через прослойки среды. Максимум (III), соответствующий средним расстояниям, характеризует потенциальный барьер, препятствующий слипанию частиц.
 |
Рис. 2. Потенциальные кривые
Вид кривых суммарной энергии взаимодействия частиц зависит от потенциала на их поверхности, от величины константы Гамакера, от размера частиц и их формы. Поэтому в зависимости от всех этих факторов различают три наиболее характерных вида потенциальных кривых, отвечающих определенным состояниям агрегативной устойчивости (рис.3).
 |
Рис. 3. Потенциальные кривые для дисперсных систем
с различной агрегативной устойчивостью
Кривая 1 соответствует такому состоянию системы, при котором на любом расстоянии между частицами энергия притяжения преобладает над
энергией отталкивания. Система неустойчива, быстро коагулирует.
Кривая 2 указывает на наличие достаточно высокого потенциального барьера и вторичного минимума. В этом случае легко образуются флокулы, в которых частицы разделены прослойками среды. Это происходит во вторичном минимуме. Такое состояние отвечает обратимости коагуляции. При некоторых условиях может быть преодолен потенциальный барьер и произойдет необратимая коагуляция в первичном минимуме.
Кривая 3 отвечает состоянию системы с высоким потенциальным барьером при отсутствии второго минимума. Такие системы обладают большой агрегативной устойчивостью.
3. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ КОАГУЛЯЦИИ ПОД
ДЕЙСТВИЕМ ЭЛЕКТРОЛИТОВ
Причиной коагуляции могут быть действие теплоты и холода, электромагнитных полей, жестких излучений, механические воздействия, химические агенты.
Чаще всего причиной коагуляции является действие электролита.
Электролиты изменяют структуру ДЭС, уменьшают дзета-потенциал (либо за счет адсорбции ионов электролита на частицах, либо за счет сжатия диффузной части ДЭС), что приводит к уменьшению электростатического отталкивание между частицами. В соответствии с теорией ДЛФО вследствие этого частицы могут подойти друг к другу на расстояния, при которых преобладают силы притяжения, что может вызвать их слипание и коагуляцию.
Порогом коагуляции (обозначается Cк, g ) называют минимальную концентрацию электролита, вызывающую за определенный промежуток времени определенный видимый эффект коагуляции (изменение цвета, помутнение, появление осадка). Порог коагуляции определяют либо визуально, наблюдая за изменениями в дисперсной системе при введении в нее растворов электролитов разной концентрации, либо регистрируют изменения с помощью соответствующих приборов, чаще всего, измеряя оптическую плотность или мутность системы.
Коагуляция подчиняется определенным правилам. Рассмотрим их.
Правила коагуляции
– Коагуляцию вызывают любые электролиты, если их концентрация
в системе превысит некоторый минимум, называемый порогом коагуляции. Причина заключается в сжатии ДЭС. Порог коагуляции для разных электролитов и разных дисперсных систем различен.
– Коагулирующим действием обладает лишь тот ион электролита, заряд которого противоположен заряду коллоидной частицы, причем его коагулирующая способность выражается тем сильнее, чем выше валентность противоиона. Эта закономерность называется правилом Шульце-Гарди. В соответствии с этим правилом соотношение порогов коагуляции одно-; двух - и трехвалентных противоионов выглядит следующим образом:

Например, для золя сульфида мышьяка As2S3 , частицы которого имеют отрицательный заряд, пороги коагуляции различных электролитов имеют следующее значение: LiCl – 58 ммоль/л; MgCl2 – 0,71 ммоль/л, AlCl3 – 0,043 ммоль/л.
В ряду органических ионов коагулирующее действие возрастает с повышением адсорбционной способности, а следовательно с нейтрализацией заряда.
– В ряду неорганических ионов с одинаковым зарядом их коагулирующая активность возрастает с уменьшением их гидратации (или с увеличением радиуса). Например, в ряду одновалентных катионов и анионов коагулирующая активность и гидратация изменяются следующим образом:
 возрастание коагулирующей активности (увеличение радиуса иона)
возрастание коагулирующей активности (увеличение радиуса иона)
Li+, Na+, K+, Rb+ Cl–, Br–, J–, CNS–
возрастание степени гидратации
– Началу коагуляции соответствует снижение x – потенциала до критической величины 25-40 мВ (~ 30 мВ).
4. СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ФАКТОРАХ
СТАБИЛИЗАЦИИ КОЛЛОИДНЫХ СИСТЕМ
В практической деятельности может возникнуть необходимость как разрушения, так и сохранения в устойчивом состоянии дисперсных систем. Для решения этих задач необходимо знать факторы устойчивости, препятствующие агрегации частиц и их выпадению в осадок.
Известно, что лиофобные дисперсные системы имеют большую поверхность раздела фаз, а следовательно и большой запас поверхностной энергии, что и является причиной их термодинамической неустойчивости (лиофильные системы отличаются высокой термодинамической устойчивостью). Поэтому стабилизация дисперсных систем происходит в том случае, если удается снизить поверхностное натяжение на границе раздела фаз. Факторы, способствующие снижению свободной поверхностной энергии, называются термодинамическими. Наряду с термодинамическим известны и другие факторы, способствующие стабилизации дисперсных систем. Кратко рассмотрим эти факторы (включая обобщение вышерассмотренного материала).
1. Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя (ДЭС) на поверхности частиц (уменьшается свободная поверхностная энергия). Этот фактор подробно рассматривается в теории ДЛФО. Возникновение ДЭС на частицах приводит к тому, что частицы приобретают одноименный заряд, что способствует их отталкиванию и препятствует слипанию в более крупные агрегаты. Таким образом, сохраняется устойчивость дисперсной системы.
2. Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой, включающем в себя процессы адсорбции и сольватации. На поверхности частиц дисперсной фазы могут адсорбироваться молекулы растворителя или других растворенных веществ. Частицы приобретают сольватную оболочку (или адсорбционно-сольватную), которая препятствует слипанию частиц. Механизм действия сил отталкивания в этом случае можно представить как совершение работы для разрушения сольватных слоев и для частичной десорбции молекул при сближении частиц. Такие системы могут быть устойчивы даже при отсутствии электрического потенциала на поверхности частиц (при отсутствии ДЭС). Такие системы мало чувствительны к электролитам (только через механизм высаливания). Примером устойчивых систем такого типа служат растворы неионогенных ПАВ, ВМС, твердых веществ, обладающих высокой гидрофильностью, (например, оксиды алюминия, кремния, железа).
3. Энтропийный фактор, как и первые два, относятся к термодинамическим. Он действует в системах, в которых частицы или их поверхностные силы участвуют в тепловом движении. Сущность его состоит в стремлении дисперсной фазы к равномерному распределению по объему системы, а это уменьшает вероятность столкновения частиц и их слипания.
Энтропийное отталкивание можно объяснить, исходя из непосредственного взаимодействия частиц с поверхностными слоями, в которых есть подвижные противоионы или длинные и гибкие радикалы поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений (ВМС). Такие радикалы обладают множеством конформаций. Сближение частиц приводит к уменьшению степеней свободы или конформаций, а это приводит к уменьшению энтропии, и, следовательно, к увеличению свободной поверхностной энергии, что является термодинамически невыгодным процессом. Таким образом, этот фактор способствует отталкиванию частиц.
4. Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью, разрушение которых требует затраты энергии и времени. Обычно такую пленку получают, вводя в систему стабилизаторы – ПАВ и ВМС (коллоидная защита). Высокие прочностные характеристики поверхностные слои приобретают благодаря переплетению цепей ВМС и длинноцепочечных ПАВ, а иногда и в результате полимеризации.
Действие структурно-механического и других факторов проявляется в таком явлении как коллоидная защита
Коллоидной защитой называется повышение устойчивости коллоидных систем за счет образования на поверхности частиц адсорбционного слоя при введении в золь определенных высокомолекулярных веществ.
Веществами, способными обеспечивать коллоидную защиту, являются белки, углеводы, пектины, а для систем с неводной дисперсионной средой – каучук. Защищающие вещества адсорбируются на поверхности дисперсных частиц, что способствует уменьшению поверхностной энергии системы. Это приводит к повышению ее термодинамической устойчивости и обеспечивает коллоидную устойчивость. Такие системы настолько устойчивы, что приобретают способность к самопроизвольному образованию. Например, растворимый кофе представляет собой тонко помолотый кофейный порошок, обработанный пищевыми поверхностно-активными веществами.
Для оценки стабилизирующего действия различных веществ введены условные характеристики: «золотое число», «рубиновое число» и т. д.
Золотое число – это минимальная масса (в мг) стабилизирующего вещества, которая способна защитить 10 мл красного гидрозоля золота (воспрепятствовать изменению цвета) от коагулирующего действия 1 см3 10%-ного раствора хлорида натрия.
Рубиновое число – это минимальная масса (в мг) стабилизирующего вещества, которая способна защитить 10 см3 раствора красителя конго красного (конго-рубина) с массовой концентрацией 0,1 кг/м3 от коагулирующего действия 1 см3 10%-ного раствора хлорида натрия.
Например, золотое число картофельного крахмала равно 20. Это означает, что 20 мг крахмала при введении его в золь золота препятствуют коагуляции золя при добавлении к золю электролита-коагулятора – 1 см3 10%-ного раствора хлорида натрия. Без добавления стабилизирующего вещества – крахмала золь золота в таких условиях коагулирует (разрушается) мгновенно.
В таблице 1 приведены значения наиболее распространенных чисел для некоторых защитных веществ.
Защитное действие имеет большое промышленное значение. Оно учитывается при изготовлении лекарственных препаратов, пищевых продуктов, технических эмульсий, катализаторов и т. д.
Таблица 1. Значения наиболее распространенных чисел для некоторых защитных веществ
Защитное вещество | Золотое число | Рубиновое число |
Желатин | 0,01 | 2,5 |
Гемоглобин | 0,06 | 0,8 |
Декстрин | 20 | – |
Крахмал картофельный | 20 | 20 |
Казеинат натрия | 0,01 | 0,4 |
ЗАКЛЮЧЕНИЕ
На сегодняшней лекции мы рассмотрели строение частиц дисперсной фазы и основные факторы, влияющие на устойчивость и разрушение дисперсных систем. Эти факторы необходимо учитывать при получении устойчивых коллоидных систем, таких как эмульсии, аэрозоли, суспензии, а также при разрушении «вредных» дисперсных систем, образующихся в процессе промышленного производства.
Доцент кафедры ФОХ


