На правах рукописи
КАПУСТИНА Анна Сергеевна
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ, ИММУНОЛОГИЧЕСКИЕ
ОСОБЕННОСТИ И ЭФФЕКТИВНОСТЬ ТЕРАПИИ
ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ У ВЗРОСЛЫХ
Специальность 14.03.09 - Клиническая иммунология, аллергология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва - 2011
Работа выполнена в ГБОУ ВПО Первый Московский государственный медицинский университет имени Минздравсоцразвития России
Научный руководитель: член-корреспондент РАМН,
доктор медицинских наук, профессор,
заведующий кафедрой клинической
иммунологии и аллергологии ФППОВ
ГБОУ ВПО Первый МГМУ им.
Официальные оппоненты: заслуженный деятель науки РФ,
доктор медицинских наук, профессор,
заместитель директора ФБУН МНИИЭМ
им. Роспотребнадзора
заслуженный врач РФ,
доктор медицинских наук, профессор,
заведующий лабораторией клинической
иммунологии ФГУ "НИИ физико-химической
медицины" ФМБА России
Ведущая организация: ГБОУ ВПО Российский национальный
исследовательский медицинский университет
им. Минздравсоцразвития России
Защита состоится « __ » _______ 2011 г. в 14-00 час. на заседании Диссертационного совета Д 208.040.08 в ГБОУ ВПО Первый МГМУ им. Минздравсоцразвития России , стр. 1.
С диссертацией можно ознакомиться в ГЦНМБ ГБОУ ВПО Первый МГМУ им. Минздравсоцразвития России г. Москва, Нахимовский пр., д.49
Автореферат разослан «____» _____________ 2011 г.
Ученый секретарь
Диссертационного совета,
доктор медицинских наук,
профессор
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В настоящее время среди актуальных проблем современной иммунологии первичные иммунодефициты (ПИД) занимают одно из ведущих мест. Основу ПИД составляет генетически обусловленная неспособность организма реализовать определенные механизмы иммунного ответа, необходимые для элиминации чужеродных агентов из организма и развития адекватных воспалительных реакций [ 2002, 2005, Goyal R. et al 2009]. Среди врожденных иммунодефицитов выделяют преимущественно гуморальные или В-клеточные иммунодефициты; комбинированные иммунодефициты (Т- и В-клеточные); дефекты фагоцитоза; дефекты комплемента; заболевания, обусловленные иммунной дисрегуляцией [Chapel H. M. et al 2003, Bonilla F. A. et al. 2005, Seger RA. 2008, Wen L. et al 2004].
С момента их открытия и до последнего времени исследование ПИД осуществлялось главным образом в педиатрии, что было связано с низкой выживаемостью больных без лечения и ранней смертью пациентов. Благодаря современной терапии продолжительность жизни детей с ПИД увеличивается.
Особенности данной нозологии у взрослого населения изучены недостаточно. У врачей первичного звена нет настороженности в отношении врожденных иммунодефицитов у взрослых. Сохраняются устаревшие представления о манифестации всех ПИД в первые месяцы и годы жизни, как о заболеваниях только детского возраста. В то же время существуют врожденные иммунодефициты, дебют которых почти в 2 раза чаще развивается после 15 лет, это относится к гуморальным дефектам иммунитета [Bergbreiter A. et al 2009, Bonilla F. A. et al. 2005, Wood R. 2009].
Таким образом, недостаток научных данных по первичным иммунодефицитам у взрослых определяет актуальность выбранного направления настоящей работы.
Цель исследования: разработка критериев ранней диагностики, тактики лечения и ведения больных старше 15 лет с первичными иммунодефицитами на основании изучения клинических проявлений, иммунологических особенностей с анализом адекватности лечебных мероприятий.
Задачи исследования:
1. изучить структуру первичных иммунодефицитов у взрослых в г. Москве;
2. изучить нозологический состав гуморальных дефектов иммунитета;
3. изучить клинико-иммунологические особенности врожденных дефектов иммунитета у взрослых;
4. оценить эффективность различных схем терапии гуморальных ПИД;
5. на основании полученных данных разработать рекомендации по ранней диагностике и тактике лечения ПИД у взрослых больных.
Научная новизна диссертации заключается в разработке системы клинико-иммунологических критериев по ранней диагностике и оценке эффективности лечения первичных иммунодефицитов у взрослого населения. Впервые разработана вербальная многофакторная модель клинических и иммунологических особенностей ПИД у взрослых больных. Впервые обоснованы алгоритмы ранней диагностики и тактики лечения первичных иммунодефицитов у взрослых. Впервые выполнена комплексная оценка качества проводимой терапии и разработаны критерии оптимизации лечения ПИД у больных старше 15 лет.
Практическая значимость работы. Разработаны клинико-лабораторные критерии ранней диагностики ПИД у взрослых. Предложены оптимальные схемы лечения ПИД в соответствии с клиническим состоянием и степенью утраты иммунной защиты у больных старше 15 лет. Разработанные алгоритмы будут способствовать как можно более ранней и точной диагностике и назначению своевременной эффективной терапии различных форм первичных иммунодефицитов у взрослых.
Основные положения, выносимые на защиту:
1. У взрослых наиболее часто встречаются преимущественно гуморальные первичные иммунодефициты.
2. У взрослых самой часто встречаемой формой ПИД с тотальным дефектом продукции антител является общая вариабельная иммунная недостаточность (ОВИН).
3. Клиническими маркерами ОВИН помимо рецидивирующих инфекций органов дыхания являются поражение желудочно-кишечного тракта с развитием синдрома мальабсорбции и аутоиммунные заболевания, в том числе аутоиммунные гемоцитопении, которые могут быть единственным признаком дебюта заболевания.
4. У больных с тотальным дефектом продукции антител отмечается выраженное снижение качества жизни, которое значительно улучшается при проведении адекватной комплексной терапии с обязательным введением препаратов внутривенных иммуноглобулинов.
5. Применение у больных наследственным ангионевротическим отеком индивидуальных планов самоконтроля существенно снижает частоту и тяжесть острых атак.
Практическое применение. Результаты исследования нашли применение в процессе ведения больных в иммунологическом отделении Городской клинической больницы №7 г. Москвы и рекомендуются для внедрения в работу терапевтов и других специалистов. Материалы диссертации включены в лекционный курс и семинарские занятия кафедры клинической иммунологии и аллергологии ФППОВ Первого МГМУ им. .
Личный вклад автора. Автор самостоятельно провел аналитический обзор отечественной и зарубежной литературы по изучаемой проблеме, составил план обследования и лечения 92 больных старше 15 лет с различными формами ПИД. Автор лично проводил сбор анамнеза заболевания и данных семейного анамнеза, клиническое обследование и анкетирование больных, анализ динамики клинических проявлений и эффективности проводимой терапии. Автором выполнен статистический анализ полученных данных, сформулированы выводы и практические рекомендации.
Апробация диссертации. Апробация диссертационной работы проведена на совместной научной конференции кафедры клинической иммунологии и аллергологии факультета послевузовского профессионального образования врачей и кафедры микробиологии, вирусологии и иммунологии медико-профилактического факультета ГБОУ ВПО Первый МГМУ им. 24.06.2011г.
Основные положения диссертации доложены и обсуждены на научно-практических конференциях: Итоговая Всероссийская научная конференция молодых исследователей «Татьянин день» и Школа молодых исследователей «Фундаментальные науки и прогресс клинической медицины» 24-26 января 2011г. (Первый МГМУ им. ); Конференция по клинической иммунологии «Диагностика и лечение иммунодефицитов» в рамках проведения образовательных семинаров “J-Project”, курируемых Европейским обществом первичных иммунодефицитов (ESID) 31 марта и 1 апреля 2011г. (РДКБ); 30-й Конгресс Европейской академии аллергологии и клинической иммунологии (EAACI) 11-15 июня 2011г. (Стамбул, Турция); Научно-практическая конференция «Актуальные вопросы клинической медицины», посвященная 15-летию работы КДЦ «МЕДСИ» 11 ноября 2011г. (Москва).
Публикации по теме диссертации. По материалам диссертации опубликовано 15 печатных работ, в том числе 3 статьи в ведущих рецензируемых изданиях, рекомендованных ВАК РФ.
Структура и объем диссертации. Диссертационная работа изложена на 131 странице машинописного текста, содержит 24 таблицы, иллюстрирована 9 рисунками, 4 клиническими примерами и состоит из введения, обзора литературы, материалов и методов исследования, результатов собственных исследований, обсуждения результатов, выводов, практических рекомендаций, списка литературы, списка сокращений и приложения. Библиографический указатель содержит 139 источников литературы, из них отечественных - 66, зарубежных - 73.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. На кафедре клинической иммунологии и аллергологии ФППОВ Первого МГМУ им. и в иммунологическом отделении ГКБ №7 г. Москвы (база кафедры) проведено комплексное обследование, лечение, изучение качества жизни 92 больных старше 15 лет в возрасте 18-74 лет с различными формами ПИД: общей вариабельной иммунной недостаточностью (ОВИН), агаммаглобулинемией с дефицитом В-клеток (АГГ), синдромом Гуда, селективным IgA-дефицитом, синдромом Вискотта-Олдрича (СВО), аутоиммунным лимфопролиферативным синдромом (АЛПС), хронической гранулематозной болезнью (ХГБ) и наследственным ангионевротическим отёком (НАО). Распределение больных по полу определялось формой иммунодефицита (табл. 1).
Таблица 1.
Общая характеристика обследованных больных
Форма первичного иммунодефицита | Диагноз | Количество больных | Муж- чины | Жен- щины | возраст |
Гуморальные иммунодефициты | Общая вариабельная иммунная недостаточность | 57 | 27 | 30 | 39,1±1,95 года |
Агаммаглобулинемия с дефицитом В-клеток | 10 | 10 | - | 23,5±1,17 года | |
Синдром Гуда | 2 | 1 | 1 | 61, 70 лет | |
Селективный IgA-дефицит | 3 | 2 | 1 | 22, 25, 38 лет | |
Комбинированный иммунодефицит | Синдром Вискотта-Олдрича | 3 | 3 | - | 19, 23, 25 лет |
Дефект фагоцитоза | Хроническая гранулематозная болезнь | 3 | 3 | - | 19, 24, 25 лет |
Дефект комплемента | Наследственный ангионевротический отёк | 12 | 3 | 9 | 42,3±2,11 года |
Заболевание, обусловленное иммунной дисрегуляцией | Аутоиммунный лимфопролиферативный синдром | 2 | 2 | - | 23 года |
Всего | 8 нозологий | 92 | 51 | 41 | 18-74 года |
Рис.1. Структура первичных иммунодефицитов у взрослых

Структура ПИД у взрослых по данным наших наблюдений представлена на рис.1. Преимущественно гуморальные иммунодефициты (ОВИН, АГГ, синдром Гуда, селективный IgA-дефицит) составляют 78,3% от общего числа обследованных ПИД (72 из 92 больных).
Общеклиническое обследование. У всех больных проводился сбор анамнеза заболевания (особое внимание уделялось возникновению первых симптомов болезни, преимущественному поражению органов и систем), анализ данных семейного анамнеза, динамики клинических проявлений, эффективности проводимой терапии. Всем больным проведено обследование, включающее физикальные методы, клинические и биохимические анализы крови и мочи в клинико-диагностической и клинико-цитологической лабораториях ГКБ №7 по общепринятым методикам. Применялись рентгенография и компьютерная томография органов грудной клетки и придаточных пазух носа, эзофагогастроскопия, колоноректоскопия (по показаниям), ультразвуковое исследование органов брюшной полости, почек, тимуса. Проводились исследования ЭКГ, функции внешнего дыхания. Больные осматривались оториноларингологом, гастроэнтерологом, пульмонологом, гематологом, ревматологом.
Иммунологическое обследование проводилось в Центре лабораторной диагностики иммунодефицитных состояний и оппортунистических инфекций при ДГП № 000. Иммунологическое тестирование включало исследование следующих параметров иммунной системы: общего числа лейкоцитов и лимфоцитов; процентного и абсолютного количества Т-лимфоцитов (CD3+-клеток), субпопуляций Т-лимфоцитов (CD4+-клеток, CD8+-клеток), NK-клеток (CD16+-клеток), В-лимфоцитов (CD19+-клеток) в периферической крови. Уровни иммуноглобулинов классов A, M, G, Е в сыворотке крови определялись с помощью нефелометрии. Иммунофенотипирование лимфоцитов периферической крови проводилось методом проточной цитофлуориметрии с использованием моноклональных антител, конъюгированных с фикоэритрином. Аутоантитела определяли методом непрямой иммунофлюоресценции. Для выявления антиэритроцитарных антител применяли пробу Кумбса. Фагоцитарное звено иммунитета исследовалось путем определения абсолютного и относительного содержания нейтрофилов и моноцитов, поглотительной активности лейкоцитов, хемилюминесценции фагоцитов и бактерицидной активности лейкоцитов. Определение концентрации компонентов системы комплемента (С3-, С4-компоненты, С1-ингибитор) в сыворотке крови проводилось иммунотурбидиметрическим методом.
Оценка эффективности и безопасности терапии ВВИГ. Определение эффективности лечения проводилось с помощью оценки динамики клинических и иммунологических показателей, длительности ремиссии основного заболевания, исследования качества жизни (КЖ) пациентов. Мониторирование уровня сывороточного IgG проводилось перед инфузией ВВИГ для оценки достижения достаточных уровней IgG (не менее 5,0 г/л). Анализ частоты возникновения инфекционных осложнений и приема антибактериальных препаратов проводился с помощью опросника «Общее самочувствие – возникновение инфекционных осложнений», заполняемый перед проведением инфузии ВВИГ, а также на 2-ой и 10-ый день после переливания препарата.
Оценка безопасности ВВИГ осуществлялась на основании данных о переносимости препаратов, анализа жизненно важных показателей и маркеров функции почек. Перед каждой инфузией ВВИГ, а также на 2-ой и 10-ый день после переливания препарата пациенты заполняли опросник «Общее самочувствие – возникновение реакций, возможно связанных с введением ВВИГ», указывая любые реакции, возникшие с момента проведения предыдущей заместительной терапии.
При назначении больному нового препарата переносимость ВВИГ оценивалась в течение 1-ой инфузии путем мониторирования АД, ЧСС, Ттела и исследования маркеров функции почек. Пациентам измеряли АД, ЧСС и Ттела перед инфузией, каждые 30 минут в течение первой инфузии и через 15 минут после окончания введения препарата. Биохимическое исследование крови с определением значений мочевины, электролитов, креатинина проводилось перед первой инфузией и на 1-ый, 2-ой и 5-ый дни после инфузии.
Исследование качества жизни. Для исследования КЖ применяли русскую версию опросника общего состояния здоровья SFitem Measures of Sickness short-form health survey). Опросник SF-36 содержит 36 вопросов, оценивает здоровье пациентов за прошедшие четыре недели по следующим критериям: физическая активность (ФА), роль физических проблем в ограничении жизнедеятельности (РФ), интенсивность боли (Б), общее здоровье (ОЗ), жизнеспособность (ЖС), социальная активность (СА), роль эмоциональных проблем в ограничении жизнедеятельности (РЭ), психическое здоровье (ПЗ), динамика состояния здоровья за прошедший год (ДЗ). Результаты отображались на шкале от 0 до 100 баллов, высокие показатели свидетельствовали о хорошем КЖ респондента, низкие – о плохом.
Статистическая обработка данных проводилась с помощью пакета программ Microsoft Exel, Windows Statistica с использованием параметрических и непараметрических методов. Полученные результаты выражались в форме среднее арифметическое (М) ± ее ошибка (m). Статистически значимыми считали различия, если вероятность случайного их характера не превышала 5% (р<0,05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Клинико-иммунологическая характеристика преимущественно гуморальных иммунодефицитов - тотальных дефектов продукции антител
ОВИН, синдром Гуда (иммунодефицит с тимомой) и АГГ объединены в группу тотальных дефектов продукции антител. Основные клинические проявления схожи – рецидивирующие инфекционные заболевания органов дыхания, ЖКТ, повышенная частота развития аутоиммунных заболеваний и злокачественных новообразований. Отличительными особенностями синдрома Гуда являются позднее начало клинических проявлений и обязательное наличие тимомы, АГГ – ранняя манифестация на первом году жизни, клеточный иммунитет интактен (табл. 2).
Таблица 2.
Гуморальные иммунодефициты - тотальные дефекты продукции антител
характеристика | ОВИН | Синдром Гуда | АГГ |
количество больных | 57 | 2 | 10 |
распределение по полу | 27 мужчин 30 женщин | 1 мужчина 1 женщина | 10 мужчин |
средний возраст | 39,1±1,95 года | 61 год и 70 лет | 23,5±1,17 года |
возраст дебюта заболевания | 19,2±0,96 года | 56 лет и 62 года | 1-11 месяцев |
основные клинические проявления | бактериальные инфекции органов дыхания (повторные/хронические синуситы, отиты, бронхиты, пневмонии) | ||
генерализованные инфекции (сепсис, остеомиелит, перитонит) | |||
герпетическая инфекция | - | ||
рецидивирующая диарея, синдром мальабсорбции | - | ||
аутоиммунные заболевания | |||
злокачественные новообразования | |||
иммунологические отклонения | тотальное снижение IgG, IgM, IgA (IgG 2,3±0,11 г/л) | ||
В-лимфоциты норма (n=41) ↑ CD19+ (n=6) ↓ CD19+ (n=10) | В-клетки отсутствуют | ||
↓CD4+, ↓CD16+, ↑CD8+ | - | ||
Клинико-иммунологическая характеристика больных ОВИН
Самую большую группу пациентов с ПИД составили 57 больных ОВИН (82,6% от всех тотальных дефектов продукции антител), 27 мужчин и 30 женщин, в возрасте от 18 до 74 лет (средний возраст 39±1,95 года). Длительность заболевания - от 3 до 62 лет (в среднем 23,6±1,18 года).
Положительный семейный анамнез выявлен у 5 (8,8%) больных (рис. 2).
Рис. 2. Родословная больной ОВИН

![]()
![]()

![]()
![]()
![]() Селективный IgA-дефицит
Селективный IgA-дефицит
![]()
![]() ОВИН
ОВИН
Первые симптомы заболевания появились у 28 больных (49,1%) до 15 лет и у 29 пациентов (50,9%) – старше 15 лет. Заболевание дебютировало у 25 больных на первом десятилетии жизни; у 10 – на втором; у 13 – на третьем десятилетии; у 9 – с 30 до 53 лет. Манифестация заболевания возможна в любом возрасте на протяжении жизни (рис. 3).
Рис 3. Возраст дебюта ОВИН

Диагноз ПИД только у 6 больных (10,5%) был установлен через 1 год после начала заболевания, у 51 пациента (89,5%) – значительно позже. Пациенты с ОВИН длительно находятся без адекватного диагноза – от момента появления первых симптомов до установки правильного диагноза проходит от 2 до 45 лет (в среднем 14,5±0,73 года). При дебюте ОВИН после 15 лет правильный диагноз устанавливался в более поздние сроки, чем при дебюте до 15 лет: запаздывание диагноза на 15,2±0,76 и 9,3±0,46 года соответственно (р<0,05). При раннем дебюте ПИД (АГГ), правильный диагноз устанавливался в более короткие сроки, чем при позднем дебюте (ОВИН): запаздывание диагноза на 3,9±0,19 и 14,5±0,73 года соответственно (р<0,05).
У 53 больных (93,0%) заболевание манифестировало с бактериальных инфекций респираторного тракта (сочетание повторных синуситов, отитов, бронхитов, пневмоний) (рис. 4). Повторные инфекции органов дыхания возникали 4-7 раз в год (в среднем 5,6±0,28), пневмонии рецидивировали от 1 раза в 2 года до 2 раз в год. У 4 пациентов (7,0%) первым проявлением ПИД было поражение ЖКТ (энтероколит и синдром мальабсорбции). У 6 больных дебют также был представлен аутоиммунными гемоцитопениями: гемолитическая анемия, нейтропения, тромбоцитопения.
Рис 4. Манифестация ОВИН

В дальнейшем до установления диагноза ПИД и проведения заместительной терапии ВВИГ у 54 больных (94,7%) сформировались очаги хронической инфекции ЛОР-органов и бронхолегочной системы (рис. 5). Частота рецидивирования хронических бактериальных инфекций составляла 5-8 раз в год (в среднем 6,3±0,31). Отличительными особенностями инфекционного процесса были полиорганность поражения, рецидивирующее, тяжелое течение, резистентность к традиционной антибактериальной терапии, склонность к хронизации и развитию осложнений, трудно достигаемая и нестойкая ремиссия.
Рис 5. Основные клинические проявления ОВИН

Поражение бронхолёгочной системы сопровождалось развитием осложнений в виде бронхиальной обструкции у 34 больных (59,6%), бронхоэктазов у,8%), пневмофиброза у,9%), хронического лёгочного сердца у 8 пациентов (14,0%); в 3,5% случаев проведена лобэктомия. У 16 пациентов (31,6%) проводились повторные гайморотомии в связи с хроническим гнойным синуситом. У 12 пациентов (21,0%) вследствие повторных гнойных перфоративных отитов развилась тугоухость (рис. 6).
Рис 6. Осложнения хронических инфекций органов дыхания при ОВИН

У 9 больных (15,8%) имелись генерализованные бактериальные инфекции в виде сепсиса, менингита, эндокардита, перитонита. У 47,4% больных инфекции органов дыхания были сопряжены с поражением ЖКТ (энтероколит, рецидивирующая диарея, синдром мальабсорбции). Таким образом, вовлечение патологии ЖКТ у взрослых происходит чаще по сравнению с детьми, у которых данные проявления наблюдаются в 30% случаев. У 24,6% - аутоиммунные заболевания (гемоцитопении, нефрит, гепатит, склеродермия), в том числе и в дебюте заболевания (рис.5). У 15,8% - злокачественные новообразования: рак желудка, кишечника, молочной железы, яичников, Т-клеточная лимфома, множественная миелома, хронический лимфолейкоз.
Также наблюдались вирусные и грибковые инфекции, что отражает поражение клеточного звена иммунитета у пациентов с ОВИН: рецидивирующая герпетическая инфекция – 47,4%, кандидоз слизистых – 21,0%, вирусный гепатит В и/или С (вследствие переливания нативной плазмы) – 33,3%. В 27 случаях (47,4%) имелись признаки незлокачественной лимфопролиферации – увеличение периферических лимфатических узлов, лимфоидная гиперплазия кишечника, спленомегалия, которые встречались изолированно или сочетанно. У 23 больных (40,4%) имелись проявления артрита с вовлечением коленных, голеностопных, локтевых, лучезапястных суставов. Суставной синдром носил характер реактивного, появлялся на фоне длительно текущих хронических инфекций.
Только у 1-й пациентки из всей группы больных ОВИН (57 человек) заболевание характеризовалось нетяжелым течением, и клинические проявления ограничивались только повторными бронхитами. Диагноз был установлен до формирования очагов хронической инфекции. Хроническая патология органов дыхания отсутствовала и еще у 2-х пациентов, однако тяжесть ОВИН у них определялась аутоиммунными гемоцитопениями (гемолитической анемией и тромбоцитопенической пурпурой).
При лабораторном исследовании со стороны анализов периферической крови больных ОВИН наиболее часто выявлялась анемия различной степени тяжести, а также лейкопения (табл. 3).
Таблица 3
Гематологические нарушения у больных ОВИН
Гематологические нарушения | Количество больных | Частота (%) |
Анемия | 33 | 57,9 |
Лейкопения (< 4,0x109/л), в том числе нейтропения (< 1,0x109/л) | 12 7 | 21,0 12,3 |
Тромбоцитопения | 5 | 8,8 |
У 4-х больных (7,0%) тяжелые гемоцитопении развились до снижения уровней сывороточных иммуноглобулинов: у 2-х больных отмечались рецидивы гемолитической анемии, тромбоцитопении и агранулоцитоз, у 2-х пациентов были зарегистрированы тромбоцитарные кризы с выраженным геморрагическим синдромом.
При первичном исследовании иммунного статуса уровни иммуноглобулинов в сыворотке крови пациентов с ОВИН были значительно снижены (табл. 4). У 3-х пациентов (5,3%) в процессе наблюдения прослежена динамика снижения сывороточного уровня IgG – прогрессирование селективного IgA-дефицита в ОВИН.
Таблица 4
Уровни Igg в сыворотке крови у больных ОВИН
до начала проведения регулярной заместительной терапии ВВИГ
Уровни Igg | Кол-во больных | Частота (%) |
Снижение всех классов Igg | 51 | 89,5 |
IgG < 4,0 г/л, из них IgG < 1,0 г/л | 57 21 | 100,0 36,8 |
Нормальные значения IgA (0,71-3,60 г/л) | 2 | 3,5 |
Нормальные значения IgM (0,40-2,63 г/л) | 3 | 5,3 |
Повышение IgM | 1 | 1,8 |
При исследовании клеточного иммунитета были выявлены многочисленные нарушения – уменьшение уровня соотношения CD4/CD8; снижение числа NК-клеток, что, возможно, обусловливает высокую предрасположенность больных ОВИН к онкологическим заболеваниям. Особо следует отметить то, что у 41% пациентов содержание В-клеток было нормальным, а у 6% повышенным, что указывает на то, что в основе дефекта антителопродукции при ОВИН лежат нарушения Т-клеточной регуляции, необходимой для созревания В-клеток (табл. 5).
Таблица 5.
Показатели клеточного иммунитета у больных ОВИН
Показатели | Средние значения | Количество больных | Частота (%) |
Снижение CD4+ | 20,5±1,03% 0,22±0,01х109/л | 29 | 50,9 |
Повышение CD8+ | 51,1±2,5% 1,3±0,06 х109/л | 22 | 38,6 |
Нормальные значения CD19+ | 13,0±0,06% 0,28±0,01 х109/л | 41 | 71,9 |
Снижение CD19+ | 3,4±0,17% 0,05±0,002 х109/л | 10 | 17,5 |
Повышение CD19+ | 26,05±1,3% 0,7±0,03 х109/л | 6 | 10,5 |
Снижение CD16+ | 3,1±0,15% 0,05±0,002 х109/л | 32 | 56,1 |
При ОВИН имеют место разнообразные нарушения и в гуморальном, и в клеточном звеньях иммунитета, однако критерием постановки диагноза данной формы ПИД наряду с клиническими проявлениями является резкое снижение уровня иммуноглобулинов в сыворотке крови (IgG, IgA и/или IgM).
Оценка эффективности и безопасности терапии гуморальных иммунодефицитов - тотальных дефектов продукции антител
В лечение было включено 49 больных, из них 39 ОВИН, 8 АГГ и 2 с синдромом Гуда. В начале лечения в фазе насыщения больные получали препараты ВВИГ в дозе 0,3г/кг веса еженедельно в течение 1,5-2 месяцев. После достижения претрансфузионного уровня IgG 5,0 г/л в фазе поддержания больные получали регулярную заместительную терапию ВВИГ в дозе 0,4-0,5г/кг. Введение препарата проводилось 1 раз в 4 недели (в среднем 1 раз в 30,5±1,5 дней) внутривенно капельно. Коррекция дозы ВВИГ проводилась с учётом ответа на терапию, контроля очагов хронической инфекции, наличия аутоиммунных заболеваний, синдрома мальабсорбции и под обязательным контролем претрансфузионного уровня IgG в сыворотке крови.
На фоне проведения регулярной заместительной терапии ВВИГ претрансфузионный уровень IgG у большинства больных составляет 5,0-8,0 г/л (в среднем 5,8±0,29 г/л) (рис. 7), а у 4-х больных, не соблюдавших режим введения ВВИГ, - 3,5-4,3 г/л.
Рис. 7. Динамика уровня IgG в сыворотке крови на фоне заместительной терапии ВВИГ

Побочные эффекты терапии ВВИГ отмечались у%) больных. У 4-х (10%) пациентов были системные реакции через 20 минут после начала введения ВВИГ - снижение АД до 60/30 мм рт ст, бронхоспазм, рвота. У%) больных после переливания повышалась температура тела до 37,3-37,90С, возникали озноб, головная боль, головокружение и общая слабость – реакция на введение большой дозы белка, что не является показанием к отмене препарата. Так как ВВИГ являются жизненно важными, осуществлялся индивидуальный подбор препаратов, при необходимости проводилась премедикация глюкокортикостероидами, антигистаминными препаратами или ингибиторами простагландинов, предварительное введение которых (за 20-30 минут до переливания ВВИГ) позволяло избежать побочных реакций.
Заместительная терапия в большинстве случаев недостаточна для контроля очагов хронической инфекции, поэтому параллельно с введением ВВИГ%) больных получают антибактериальные препараты широкого спектра действия. На фоне проводимого лечения достоверно (р<0,05) снизилась частота обострений очагов хронической инфекции в 2,86 раза - до 2-3 раз в год (2,2±0,11 раз в год). В связи с непрерывным рецидивированием герпетической инфекции 4 пациентки постоянно получают препараты ацикловира. У 7 больных с аутоиммунной тромбоцитопенией и анемией проводилась иммуносупрессивная терапия. У 5 пациентов с нейтропенией применялись препараты гемопоэтических ростовых факторов, 2 больных получают терапию ростовыми факторами постоянно. С помощью применения комплексной терапии редкие обострения хронического бронхита, синусита, отита, герпеса протекают менее тяжело, уменьшились проявления мальабсорбции, достигнута ремиссия аутоиммунных гемоцитопений, регрессировали признаки реактивного артрита.
До проведения адекватной терапии у пациентов с тотальным дефектом продукции антител отмечены выраженные ограничения во многих сферах жизнедеятельности – тяжело переносимые болевые ощущения приводят к снижению физической и социальной активности, в связи с физическими и эмоциональными проблемами возникают ролевые ограничения. Через 2 года комплексной терапии в адекватных дозах отмечалась положительная динамика показателей КЖ, особенно было отмечено значительное улучшение в психоэмоциональной сфере пациентов (парный t критерий, р<0,05) и нормализация ролевых ограничений из-за эмоциональных проблем (парный t критерий, р<0,05) (рис. 8).
Рис. 8. Динамика качества жизни пациентов с тотальным дефектом продукции антител на фоне ежемесячной заместительной терапии ВВИГ и приема антибактериальных препаратов

На основании всестороннего анализа полученных результатов нами разработан алгоритм действий врачей по диагностике и терапии гуморальных ПИД у взрослых (рис. 9).
Рисунок 9
Алгоритм действий врачей по диагностике и терапии
ПИД - ОВИН у взрослых

Клинико-иммунологическая характеристика и эффективность терапии больных НАО
Под наблюдением находилось 12 пациентов с НАО, 9 женщин и 3 мужчин, в возрасте от 19 до 70 лет (средний возраст 42,3±2,11 года). Положительный семейный анамнез прослеживался в нескольких поколениях в,3%) случаях (рис. 10).
Рис. 10. Родословные больных НАО


Наследственный ангионевротический отёк
Первые клинические проявления появились у,3%) больных в возрасте 3-12 лет, у 2-х (16,7%) позже – в 16 и 18 лет (рис. 11). Средний возраст дебюта: 10,5±0,53 года. Во всех случаях диагноз установлен значительно позже манифестации НАО - на 7-48 лет (в среднем на 23,7±1,18 года). Средний возраст установления правильного диагноза: 34,2±1,71 года.
Рис. 11. Возраст дебюта НАО

Отёки рецидивировали от 2-х до 15 раз в год: у 5 больных (41,67%) 2-5 раз в год, у 5 (41,67%) - ежемесячно, у 2-х (16,66%) – ≥2 раз в месяц (в среднем 10,2±0,51 раз в год) (рис. 12). Отёки возникали спонтанно, а также вследствие травм, физических нагрузок, стресса, стоматологических вмешательств, косметических манипуляций.
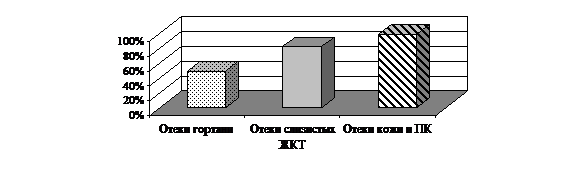
У 6 (50%) больных рецидивировали отёки гортани, у%) - отёки слизистых ЖКТ, у%) - отёки кожи и подкожной клетчатки (ПК) (рис.13). У 2-х проводились трахеотомии в связи с развитием асфиксии и клинической смерти после экстракции зуба.
Рис. 12. Частота рецидивирования отеков

Симптомы отека слизистых ЖКТ (сильные боли в животе, вздутие живота, рвота, диарея без повышения температуры тела) расценивались врачами как «пищевая токсикоинфекция», «обострение хронического панкреатита», «острый живот». Операции проводились 3-м больным: данных за острую хирургическую патологию не получено, но удаляли аппендикс, матку, яичник, желчный пузырь, отёчный участок кишечника.
Отёки кожи и ПК вовлекали лицо, конечности, ягодицы. Отёки были плотные, с ощущениями распирания, бледные, без зуда и крапивницы; антигистаминные препараты и системные кортикостероиды были неэффективны. Отёки медленно нарастали в течение 3-10 часов и постепенно разрешались - в среднем в течение 3-х дней. Наиболее часто выставлялся ошибочный диагноз «рецидивирующие аллергические отёки».
Рис. 13. Клинические проявления НАО
При иммунологическом обследовании выявлены значительные отклонения в системе комплемента: резкое снижение С1-ингибитора до 0,046-0,063 г/л у 11 больных – НАО I типа; уровень С1-ингибитора повышен до 0,54 г/л, но его активность равна нулю у 1 пациентки – НАО II типа; резкое снижение С4-компонента комплемента до 0,043-0,069 г/л у всех пациентов.
Для каждого больного был разработан индивидуальный план самоконтроля, включающий наряду с базисной терапией минимально достаточной дозой даназола перечень ограничений провоцирующих атаки факторов, мероприятия, которые необходимо соблюдать при первых признаках отёка, а также при высокой вероятности воздействия факторов, провоцирующих отёки. В связи с частыми и тяжёлыми проявлениями 7 пациентов получают даназол 50-200 мг/сутки. Дозы и кратность приёма подбирались индивидуально в зависимости от выраженности клинических проявлений и ответа на терапию. При первых признаках отёка проводилось увеличение дозы даназола, введение аминокапроновой кислоты, в результате отёки купировались на ранней стадии. Перед плановой операцией даназол назначался в высокой дозе. В послеоперационном периоде с профилактической целью вводилась аминокапроновая кислота.
На фоне соблюдения плана самоконтроля отёки не развиваются у 5 больных в течение 2-4 лет, у 7 пациентов частота отёков снизилась в 4-6 раз, протекают менее тяжёло. В среднем частота рецидивирования острых атак снизилась в 5,23 раза и в настоящее время составляет 1,95±0,09 раза в год.
На основании всестороннего анализа полученных результатов нами разработан алгоритм действий врачей по диагностике и терапии редкой формы ПИД – НАО у взрослых (рис. 14).
Рисунок 14. Алгоритм действий врачей по диагностике и терапии
|
 |
ВЫВОДЫ
1. Создан московский регистр взрослых больных первичными иммунодефицитами, на 78,3% представленный преимущественно гуморальными дефектами иммунитета.
2. У взрослых первичные иммунодефициты с тотальным дефектом продукции антител на 82,6% представлены ОВИН, которая может манифестировать в любом возрасте. Поражение желудочно-кишечного тракта в виде энтероколита и синдрома мальабсорбции наряду с рецидивирующими инфекциями органов дыхания является ведущим признаком ОВИН. Аутоиммунные гемоцитопении могут быть дебютом ОВИН.
3. Применение адекватной заместительной терапии ВВИГ в комплексе с антибактериальными препаратами широкого спектра действия у больных ПИД с тотальным дефектом продукции антител позволило снизить частоту инфекционных осложнений в 2,86 раза. Обострения хронических инфекций связаны с несоблюдением режимов терапии, с поздним началом адекватного лечения и крайне тяжелым состоянием больных.
4. Применение у больных НАО индивидуальных планов самоконтроля, включающих подбор базисной терапии даназолом, перечень ограничений провоцирующих факторов и разработанный план действия пациента при минимальных признаках отёка, позволило снизить частоту острых атак в 5,23 раза.
5. Полученные данные позволили разработать систему критериев и алгоритмы ранней диагностики и терапии ПИД у взрослых. Адекватное лечение позволило увеличить продолжительность жизни пациентов, сохранить трудоспособность и существенно повысить качество жизни.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Для своевременной диагностики врожденного иммунодефицита у взрослых необходимо направлять пациентов любого возраста обоего пола на консультацию к аллергологу-иммунологу при наличии хотя бы одного критерия ранней клинической диагностики ПИД.
2. В качестве лабораторного маркера ПИД с тотальным дефектом продукции антител рекомендуется применять уровень IgG, НАО – уровень С4-компонента комплемента в сыворотке крови.
3. Больных ОВИН с поздним дебютом заболевания следует обследовать на возможное наличие у них синдрома Гуда – иммунодефицита с тимомой.
4. У больных НАО следует применять индивидуальные планы самоконтроля, разработанные для каждого пациента.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. , , Клинико-иммунологические особенности и терапия общей вариабельной иммунной недостаточности у взрослых.// Труды Национальной конференции, Москва. Российский аллергологический журнал, 2008, №1, прилож. 1, - с. 127-129.
2. , , Алгоритм выявления первичных иммунодефицитов с преимущественным нарушением антителопродукции у взрослых.// Сборник трудов конгресса, Казань. Российский аллергологический журнал, 2009, №3, вып. 1, - с. 139-140.
3. , , , Миткова диагностики общей вариабельной иммунной недостаточности у взрослых.// Труды Национальной конференции, Москва. Российский аллергологический журнал, 2010, №1, вып. 1, - с. 80-81.
4. , , В, , Эффективность внедрения индивидуальных планов самоконтроля у больных наследственным ангионевротическим отёком.// Труды Межрегионального форума, Санкт-Петербург. Российский аллергологический журнал, 2010, №5, вып. 1, -с. 131-132.
5. , , Андросов органов дыхания при общей вариабельной иммунной недостаточности./ Сборник трудов конгресса. ХХ Национальный конгресс по болезням органов дыхания // - М.: ДизайнПресс, 2010. –с. 144-145.
6. С. Наследственный ангионевротический отёк – редкая форма первичного иммунодефицита у взрослых. Критерии диагностики. - Тезисы итоговой всероссийской научной конференции молодых исследователей с международным участием «Татьянин день».// - М.: ГЭОТАР-Медиа, Приложение к журналу «Сеченовский вестник» №1(3), 2011. - с. 65.
7. Эффективность терапии первичных иммунодефицитов с тотальным дефектом продукции антител у взрослых. - Тезисы итоговой всероссийской научной конференции молодых исследователей с международным участием «Татьянин день».// - М.: ГЭОТАР-Медиа, Приложение к журналу «Сеченовский вестник» №1(3), 2011. - с. 65-66.
8. A.S. Kapustina, I. V. Sidorenko, A. V. Karaulov, V. V. Androsov, S. V. mon variable immunodeficiency in adults: major approaches in early diagnostics in Moscow./ The 30th Congress of the European Academy of Allergy and Clinical Immunology/ Abstract Book, Istanbul, Turkey, June 2011, abstr 1249.
9. A.S. Kapustina, I. V. Sidorenko, A. V. Karaulov, V. V. Androsov, S. V. Mitkova. Effectiveness of personal self-management plans in patients with hereditary angioedema in Moscow./ The 30th Congress of the European Academy of Allergy and Clinical Immunology/ Abstract Book, Istanbul, Turkey, June 2011, abstr 1118.
10. , , Синдром Гуда - редкая форма первичного иммунодефицита с поздними клиническими проявлениями у взрослых.// Труды Международного конгресса, Москва. Российский аллергологический журнал, 2011, №4, вып. 1, - с. 166-167.
11. , , А. С. Капустина. Первичные иммунодефициты у взрослых: общая вариабельная иммунная недостаточность – клинические проявления, иммунологические и генетические дефекты, лечение.// Терапевтический архив, 2011, №10: 49-54.
12. , , . Совершенствование верификации и тактики ведения первичного иммунодефицита – общей вариабельной иммунной недостаточности у взрослых.// Иммунопатология, аллергология, инфектология, 2011, №3: 32-41.
13. , , . Оптимизация диагностики и терапии редкого первичного иммунодефицита - наследственного ангионевротического отека у взрослых.// Иммунопатология, аллергология, инфектология, 2011, №3: 42-49.
14. , . Совершенствование диагностики общей вариабельной иммунной недостаточности у взрослых в Москве./ Материалы научно-практической конференции «Актуальные вопросы клинической медицины», посвященной 15-летию работы КДЦ «МЕДСИ», 2011, - с. 147-148.
15. , . Эффективность внедрения индивидуальных планов самоконтроля у больных наследственным ангионевротическим отеком в Москве./ Материалы научно-практической конференции «Актуальные вопросы клинической медицины», посвященной 15-летию работы КДЦ «МЕДСИ», 2011, - с. 149-150.
СПИСОК СОКРАЩЕНИЙ
ПИД – первичные иммунодефициты
ОВИН – общая вариабельная иммунная недостаточность
НАО – наследственный ангионевротический отек
ВВИГ – внутривенный иммуноглобулин
АГГ – агаммаглобулинемия с дефицитом В-клеток
АЛПС – аутоиммунный лимфопролиферативный синдром
ХГБ – хроническая гранулематозная болезнь
СВО – синдром Вискотта-Олдрича
ЖКТ – желудочно-кишечный тракт
АГА – аутоиммунная гемолитическая анемия
Г-КСФ – гранулоцитарный колониестимулирующий фактор
КЖ – качество жизни
АД – артериальное давление
ЧСС – частота сердечных сокращений
Ттела – температура тела
ПК – подкожная клетчатка
IgG – иммуноглобулин G
Igg – иммуноглобулины


