На правах рукописи
Топоркова
Анастасия Константиновна
ВЛИЯНИЕ НАНОСТРУКТУРИРОВАННЫХ
МНОГОФУНКЦИОНАЛЬНЫХ БИОСОВМЕСТИМЫХ
НЕРЕЗОРБИРУЕМЫХ ПОКРЫТИЙ ИНТРАОССАЛЬНЫХ
ИМПЛАНТАТОВ НА ПРОЦЕСС ИХ ИНТЕГРАЦИИ В КОСТЬ
(экспериментально-морфологическое исследование)
14.00.21- Стоматология
14.00.15 - Патологическая анатомия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва - 2009
Работа выполнена в ФГУ «Центральный научно-исследовательский институт стоматологии и хирургия" href="/text/category/chelyustnaya_hirurgiya/" rel="bookmark">челюстно-лицевой хирургии Росмедтехнологий».
Научные руководители:
Доктор медицинских наук, профессор
Доктор медицинских наук, профессор
Официальные оппоненты:
Доктор медицинских наук, профессор
Доктор медицинских наук, профессор
Ведущая организация:
ФГОУ "Институт повышения квалификации Федерального медико-биологического агентства России"
Защита состоится 16 декабря 2009 г. в 10-00 часов на заседании Диссертационного совета (Д.208.111.01) в ФГУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Росмедтехнологий» по адресу: Москва, ул. Тимура Фрунзе, д. 16 (конференц-зал).
С диссертацией можно ознакомиться в библиотеке ФГУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Росмедтехнологий» по адресу: Москва, ул. Тимура Фрунзе, д. 16.
Автореферат разослан 16 ноября 2009 г.
Ученый секретарь Диссертационного Совета,
кандидат медицинских наук
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Одной из центральных проблем стоматологии и челюстно-лицевой хирургии в области разработки, апробации и клинического применения дентальных имплантатов и конструкций для черепно-челюстно-лицевого остеосинтеза на сегодняшний день, как и прежде, является их совершенствование путём повышения их интеграционного потенциала и улучшения их прочностных характеристик (, 2002; и соавт., 2007; A. Jokstad, 2008; D. G. Olmedo et al., 2009).
Согласно данным литературы, оптимальной формой интеграции имплантатов в костную ткань признаётся остеоинтеграция, форма процесса непосредственного контакта имплантата с костной тканью без участия соединительной ткани (, 2005; и соавт., 2006; и соавт., 2006; M. Haga et al., 2009). Особое значение в формировании интеграционного потенциала имплантатов придаётся физико-химическим характеристикам поверхности последних (, 2007; P. Schupbach, 2005). Для модификации поверхности имплантата (создания шероховатости, микрорельефа) в настоящее время применяются различные методы (пескоструйная обработка, травление кислотами, плазменное напыление титана и т. д.). Однако все эти работающие методы несущественно изменяют интеграционный потенциал имплантата (V. C. Colnot et al., 2007; A. Palmquist et al., 2009).
Для улучшения остеоинтеграции имплантатов их поверхность часто покрывают слоем гидроксиапатита, однако низкие прочность, стойкость к ударным нагрузкам и резорбция покрытия ограничивают его применение для конструкций, работающих под нагрузкой в костной системе ( и соавт., 2000; и соавт., 2003).
Одним из решений проблемы получения нового поколения имплантатов является нанесение на их поверхность биосовместимых нерезорбируемых покрытий.
В настоящее время активно используются покрытия на основе карбидов и нитридов титана благодаря их высоким механическим и биоактивным свойствам ( и соавт., 2004; S. Piscanec et al., 2004; Y. Dong et al., 2007). Разрабатываются так же новые наноструктурированные многофункциональные биосовместимые нерезорбируемые покрытия (МБНП) на основе карбонитрида титана с добавлением в их состав Ca, P и O, что, как предполагается, позволит получить новый класс материалов, обладающих высоким комплексом механических характеристик, а так же значительным интеграционным потенциалом ( и соавт., 2005; и соавт., 2008).
Создание отечественных высококачественных наноструктурированных изделий нового поколения с высокими показателями интеграционной активности и при этом более дешевых, чем импортные, обеспечит населению России более доступную дентальную имплантологию и приведет к повышению качества оказываемых стоматологических услуг.
Все вышеуказанное свидетельствует об актуальности и перспективности использования наноструктурированных МБНП поверхности внутрикостной части дентальных имплантатов. Исследований интеграционного потенциала этих покрытий в костную ткань проведено не было, что послужило основанием для выполнения настоящей работы.
Цель исследования: совершенствование имплантатов, применяемых в стоматологии и челюстно-лицевой хирургии, посредством использования наноструктурированных многофункциональных биосовместимых нерезорбируемых покрытий, повышающих интеграционный потенциал имплантатов.
Задачи исследования
1. Оценить в опытах in vitro интенсивность процессов адгезии и распластывания клеток культуры эмбриональных фибробластов человека на поверхности образцов титановых пластин, а так же нитей и пластин из политетрафторэтилена (ПТФЭ) с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями.
2. Исследовать в опытах на крысах влияние наноструктурированных многофункциональных биосовместимых нерезорбируемых покрытий на процесс интеграции фрагментов титановой проволоки имплантированных в бедренную кость.
3. Оценить и сопоставить в опытах на собаках с экспериментально воспроизведенной частичной адентией выраженность интеграции интраоссальных имплантатов фирмы «Конмет» без покрытий и с наноструктурированным покрытием состава Ti-Ca-P-C-O-N в кость.
4. Исследовать в опытах на крысах интеграционный потенциал образцов политетрафторэтиленовых нитей с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями при имплантации их в бедренную кость.
5. В опытах на кроликах, изучить возможность применения пластин из политетрафторэтилена с покрытием Ti-Ca-P-C-O-N для устранения обширных дефектов плоских костей черепа, оценив при этом их интеграционный потенциал в сопоставлении с политетрафторэтиленовыми пластинами без покрытия.
Научная новизна
Впервые в экспериментах in vivo, в том числе на основании данных гистоморфологического исследования, установлено значимое повышение интеграционного потенциала, которое достигается в результате нанесения на внутрикостные имплантаты покрытия состава Ti-Ca-P-C-O-N, и выражается в формировании в периимплантатной зоне новообразованных костных структур, что указывает на течение интеграционного процесса по типу остеоинтеграции.
Впервые в опытах in vitro в соответствии с государственным стандартом Российской Федерации ГОСТ Р ИСО 10993.5-99 (Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro) методом прямого контакта с культурой эмбриональных фибробластов человека установлен высокий уровень биологической совместимости имплантационных материалов с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями.
Разработан новый гибридный имплантационный материал на основе политетрафторэтилена с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями, который предлагается для устранения дефектов плоских костей [Патент на изобретение № 000 от 01.01.2001].
Разработана новая экспериментальная модель внутрикостного имплантата, состоящая из политетрафторэтилена с металлическим нанопокрытием, которая позволяет изучать тонкие морфофункциональные характеристики тканевых структур периимплантатной зоны и молекулярные механизмы интеграции имплантационных материалов в кость при помощи гистологических, иммуногистохимических и электронно-микроскопических методов.
Практическая значимость
Разработаны и предлагаются для применения в практической стоматологии и челюстно-лицевой хирургии отечественные высококачественные наноструктурированные многофункциональные биосовместимые нерезорбируемые покрытия дентальных имплантатов, а также конструкций для черепно-челюстно-лицевого остеосинтеза с высокими показателями интеграционной активности и при этом более дешевых, чем импортные.
Разработаны и обоснованы для применения в клинике имплантаты нового класса на основе политетрафторэтилена с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями для устранения дефектов плоских костей.
Научные положения, выносимые на защиту
1. Результаты экспериментально-морфологического исследования области контакта образцов титановых имплантатов с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями и тканевых, в том числе костных, структур периимплантатной зоны, свидетельствуют о высоком интеграционном потенциале исследуемых покрытий, что находит своё отражение в превалировании остеогенеза над образованием соединительной ткани в области контакта имплантат – тканевый субстрат.
2. Исследование адгезии и распластывания эмбриональных фибробластов человека на поверхностях образцов из титана и политетрафторэтилена с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями выявили повышение интенсивности клеточной кинетики на образцах с данными покрытиями.
3. Результаты исследования морфофункциональных характеристик тканевых структур периимплантатной зоны при имплантации образцов политетрафторэтилена с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями в кость, свидетельствуют об их высоком остеоинтеграционном потенциале.
Апробация работы
Результаты диссертационной работы доложены и обсуждены на: всероссийском совещании «Биокерамика в медицине» (Москва, 2006); Симпозиуме «Актуальные вопросы тканевой и клеточной трансплантологии» (Москва, 2007); Британо-Российском совещании по стволовым клеткам «Стволовые клетки: законодательство, исследования и инновации» (Москва, 2007).
Предзащитное обсуждение материалов исследования проведено на совместном заседании сотрудников структурных подразделений ФГУ «ЦНИИС и ЧЛХ Росмедтехнологий»: отдела общей патологии; отделения клинической и экспериментальной имплантологии; отделения ортопедической стоматологии и имплантологии; отделения амбулаторной хирургической стоматологии.
Публикации
Основные результаты диссертационного исследования отражены в 9 научных работах, из них 4 статьи опубликованы в ведущих рецензируемых изданиях, включенных в перечень ВАК РФ; 1 патент на изобретение и 1 монография.
Объем и структура диссертационной работы
Диссертационная работа изложена на 145 страницах машинописного текста, состоит из введения, трех глав, обсуждения, выводов, практических рекомендаций и списка литературы. Работа иллюстрирована 104 рисунками. Список литературы содержит 153 источника, в том числе 46 отечественных и 107 иностранных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Материал исследования. Объектом исследований в настоящей работе явились наноструктурированные МБНП в системах Ti-Ca-P-C-O-N и Ti-Ca-Mn-K-C-O-N, которые имеют уникальное сочетание физико-механических и коррозионных свойств, а именно: пониженный модуль упругости – 170-270 ГПа; высокую адгезионную прочность к подложке до 50 Н; высокую степень упругого восстановления до 75%; низкий коэффициент трения 0.12-0.22; низкую скорость износа – 1мм3/Нм; низкую шероховатость Rrms=0.13-1.5 нм; высокую твердость – 30-40 ГПa; высокое сопротивление пластической деформации 0.9 ГПа, определяемое соотношением H3/E2; высокие значения H/E как показателя долговечности и износостойкости покрытий; отрицательный заряд поверхности при pH=7.
В качестве подложек для нанесения покрытий использовали следующие материалы:
1. Титан марок ВТ1-0 (ГОСТ ) в виде пластин размерами 20 мм Х 20 мм Х 5 мм и проволоки длиной 10 мм и Ø 0.5 мм.
2. Внутрикостные дентальные винтовые титановые имплантаты Ø 4.0 мм и длиной 10 мм (производитель , Москва).
3. ПТФЭ пластины марки МКТ10 (ГОСТ Е), размерами 20 мм Х 20 мм Х 5 мм и с пористостью 36%, а так же ПТФЭ нить марки 5035 длиной 10 мм, Ø 0.5 мм с пористостью 2-3% (производитель НПО «Экофлон», СПб).
Методика получения наноструктурированных МБНП. Для получения наноструктурированных МБНП применяли композиционные мишени составов TiC0.5+10%CaO+2%KMnO4, и ТiC0.5+Ca10(PO4)6(OH)2 синтезированные по технологии силового СВС-компактирования на базе опытно-промышленного участка самораспространяющегося высокотемпературного синтеза Научно-учебного центра СВС МИСиС-ИСМАН. Для нанесения металлического (Ti) покрытия на ПТФЭ использовалась мишень из чистого титана.
Осаждение покрытий на подложки осуществляли с применением комбинированной установки вакуумного напыления на базе имплантора высокоэнергетических ионов «Сокол-50/20» в течение 60 минут путем магнетронного распыления композиционных мишеней в газовой смеси аргона с азотом, при парциальном давлении азота 14%. В процессе напыления давление в вакуумной камере и температура подложки составляли соответственно 0.2 Пa и 120-150оС. Толщина покрытия составляла 0.9-1.1 мкм.
Методы исследования in vitro с культурой эмбриональных фибробластов человека. Для решения вопроса о способности наноструктурированных МБНП влиять на интенсивность адгезии клеток, их распластывания и пролиферации на поверхности имплантатов использовали стандартную методику исследования на цитотоксичность (ГОСТ Р ИСО 10993.5-99), которая предусматривает проведение инкубации клеточной культуры кожно-мышечных фибробластов эмбрионов человека непосредственно в контакте с испытуемыми образцами.
Оценку морфологии и жизнеспособности клеток проводили на инвертированном микроскопе Axiovert 200 (Carl Zeiss, Германия) с использованием метода окрашивания клеток 0.0002% раствором акридинового оранжевого в фосфатном буфере.
Для исследования методом сканирующей электронной микроскопии (СЭМ) была проведена процедура фиксации клеток на поверхности материалов. По истечении 72 часов с момента посева клеток образцы промывали 0.1 М фосфатно-солевым буфером (ФСБ), рН 7.4, после чего фиксировали в течение 2 часов 2.5% раствором глутарового альдегида в ФСБ. После удаления фиксирующего раствора образцы промывали ФСБ и проводили дегидратацию материала, после удаления этанола образцы помещали на 30 минут в гексаметилдисилазан, после чего высушивали на воздухе. Окончательное высушивание образцов осуществляли методом перехода через критическую точку на аппарате Hitachi CPD-1 (Critical Point Dryer). После чего их фиксировали на предметные столики и напыляли смесью золото-палладий, используя установку Eiko-IB3 (Ion coater) при следующем режиме: ионный ток – 6 мА, межэлектродное напряжение – 1.5 kV, что позволяло получать толщину слоя напыления около 25 нм. Изучение объектов проводили на аппарате CamScan S-2 (Cambridge Scanning) в режиме регистрации вторичных электронов при ускоряющем напряжении 20 kV. Захват и обработку видеоизображения на персональном компьютере реализовывали с использованием программно-аппаратного комплекса Microcapture 2.2 (системы для микроскопии и анализа).
Поскольку данное исследование раскрывает лишь «локальный» адгезионный потенциал испытуемых образцов, в работе были проведены экспериментальные исследования in vivo. Эти исследования проводились по двум разделам:
1. Эксперименты по изучению интеграционного потенциала титановых имплантатов с наноструктурированными МБНП и без таковых
a. на модели имплантации образцов титановой проволоки в бедренную кость крыс;
b. на модели экспериментально воспроизведенной частичной адентии у собак с имплантацией титановых дентальных имплантатов.
2. Эксперименты по изучению интеграционного потенциала образцов ПТФЭ с наноструктурированными МБНП и без таковых
a. на модели имплантации образцов ПТФЭ нити в бедренную кость крыс;
b. на модели краниопластики высокопористыми ПТФЭ пластинами.
Методы исследования интеграции образцов титановой проволоки с покрытиями в бедренную кость крыс. Эксперимент выполнен на 48 половозрелых крысах-самцах линии «Вистар», весом 200-250 г, по 4 животных на точку наблюдения. Животные были распределены на 3 группы:
Группа 1. Титановая проволока с покрытием Ti-Ca-Mn-K-C-O-N
Группа 2. Титановая проволока с покрытием Ti-Ca-P-C-O-N
Группа 3. Титановая проволока без покрытия (контроль)
Методика экспериментальной операции. В условиях стерильной операционной после обработки операционного поля, под калипсоловым наркозом без предварительной примедикации (калипсол вводился внутрибрюшинно, при необходимости поддержания анестезии калипсол вводился внутримышечно; средняя доза калипсола 16,9±1,1мг/100г веса); произведен разрез кожи и подкожно-жировой клетчатки по передней поверхности левого бедра длинной 15 мм. Края раны мобилизованы, продольно рассечен мышечный слой и надкостница, отпрепарирована передняя поверхность бедренной кости в области диафиза. С помощью бормашины бором №1 произведен продольный пропил кортикальной пластины и губчатого вещества кости длинной 10 мм, шириной 0.5 мм, глубиной 0.5 мм. В полученный дефект костной ткани установлен стерильный имплантат, длинной 10 мм, Ø 0.5 мм. Имплантат фиксирован к бедренной кости двумя лигатурами кетгут 4/0. Рана послойно ушита узловыми швами, полностью укрывая имплантат. Гемостаз произведен по ходу операции. Кожная рана ушита узловыми швами полигликолид 4/0.
Животных выводили из опытов в сроки 10, 20, 30 и 90 суток после оперативного вмешательства посредством внутрибрюшинного введения калипсола в летальной дозе (750 мг/кг массы тела экспериментального животного). Материал, подлежащий исследованию (бедренная кость), фиксировали в 10% нейтральном формалине 48 часов.
Выделенные и освобожденные от мягких тканей костные фрагменты подвергали декальцинации в 25% Имплантаты из титановой проволоки аккуратно удаляли после декальцинации. Тканевые образцы проводили через спирты возрастающих концентраций и заключали в парафин.
Срезы готовили с помощью ротационного микротома Microm HM 355S толщиной 6-7 микрон и окрашивали гематоксилином-эозином. Изучение гистопрепаратов и микрофотосъёмку производили в оптической цифровой системе Axioplan 2 imaging (Carl Zeiss, Германия).
Для верификации и объективизации данных гистоморфологического исследования использовали морфометрическую полуколичественную оценку состояния тканевых структур периимплантатной зоны по пятибалльной шкале, по ряду критериев: «масштабы» образования волокнистых структур по площади; уровень зрелости волокнистых структур (соотношение удельного веса преколлагеновых и коллагеновых фибрилл); наличие костных структур.
Методы исследования интеграции опытных образцов дентальных имплантатов с МБНП в нижнюю челюсть собак. Эксперимент выполнен на 2 беспородных собаках в возрасте лет с массой и 7000 г.
Методика экспериментальной операции. Этап I. В условиях стерильной операционной после обработки операционного поля, под внутримышечным наркозом (Тиопентал натрий 2,5% - 4ml) без предварительной примедикации произвели удаление второго и третьего премоляра с двух сторон на нижней челюсти при помощи бормашины, элеватора и клювовидных щипцов. Произвели кюретаж лунок удаленных зубов. Гемостаз по ходу операции. На лунки наложены сближающие швы кетгутом 3/0.
Этап II. Установку имплантатов производили через 3 месяца после удаления зубов. В условиях стерильной операционной после обработки операционного поля, под внутримышечным наркозом (Тиопентал натрий 2,5% - 4ml) без предварительной примедикации произвели разрез слизистой по гребню альвеолярного отростка нижней челюсти слева в области ранее удаленных зубов. Отслоили слизисто-надкостничный лоскут с вестибулярной и язычной сторон на 5 мм. Специальными титановыми фрезами сформировали 4 ложа под имплантаты системы «Конмет». Произвели антисептическую обработку операционного поля 0.05% раствором хлоргексидина. Установили 4 имплантата системы «Конмет» Ø 4.0 мм и длиной 10 мм без покрытия (слева) и с покрытием Ti-Ca-P-C-O-N (справа). Установили заглушки на имплантаты. Слизисто-надкостничный лоскут уложили на место, рану ушили полигликолидом 4/0.
Назначили превентивную антибиотикотерапию: Медоцеф 0.5, 1 раз в день, внутримышечно, курсом 5 суток. Динамическое наблюдение. Швы сняты на 8-е сутки. После операции животных содержали преимущественно на мягкой пище, мясо давали исключительно бескостное. Послеоперационный период протекал без осложнений. Собак выводили из экспериментов через 4 месяца после II этапа экспериментальной операции (установки имплантатов) передозировкой Тиопентала натрия. Выделяли нижние челюсти, производили их скелетирование и рентгенологическое исследование. Далее тканевый материал фиксировали в течение 4 суток в 10% нейтральном формалине с ежесуточной сменой растворов. Производили СЭМ исследование зоны контакта имплантат – кость.
Методы исследования интеграции образцов ПТФЭ нити с покрытиями в бедренную кость крыс. Эксперимент выполнен на 48 половозрелых крысах-самцах линии «Вистар», весом 200-250 г, по 4 животных на точку наблюдения. Животные были распределены на 4 группы:
Группа 1. Нить из ПТФЭ с покрытием Ti-Ca-P-C-O-N
Группа 2. Нить из ПТФЭ с покрытием Ti-Ca-Mn-K-C-O-N
Группа 3. Нить из ПТФЭ с покрытием Ti (контроль)
Группа 4. Нить из ПТФЭ без покрытия (контроль)
Методика экспериментальной операции. См. выше.
Животных выводили из опытов в сроки 15, 30 и 60 суток после оперативного вмешательства. Проводили гистоморфологическое исследование.
Методы исследования интеграции образцов ПТФЭ пластин с МБНП в теменную кость кроликов. Эксперимент выполнен на 6 кроликах-самцах породы Шиншилла, массой ~2500 г. Животные были распределены на 2 группы:
Группа 1. Пластины из ПТФЭ с покрытием Тi-Ca-P-C-O-N.
Группа 2. Пластины из ПТФЭ без покрытия.
Методика экспериментальной операции. В условиях стерильной операционной после обработки операционного поля, под внутримышечным наркозом (Тиопентал натрий 2,5% - 1.5ml) без предварительной примедикации через разрез кожного покрова с помощью фрезы №1 выпиливали и удаляли фрагмент теменной кости (наружную и внутреннюю кортикальные пластины) размерами 10 мм Х 10 мм. После гемостаза на костных краях дефектов 2-мя титановыми микровинтами сечением 2.0 мм и длиной 2.0 мм фиксировали пластины из высокопористого ПТФЭ с покрытием состава Ti-Ca-P-C-O-N (основная группа) и ПТФЭ пластины без покрытия (контроль).
Животных выводили из эксперимента передозировкой Тиопентала натрия в сроки 3 и 6 месяцев по 2 животного на срок в подопытной группе и по 1 – в группе контроля. Тканевый материал из области экспериментального воздействия: область дефекта с имплантатами и прилежащей костной тканью в пределах 5 мм (всего тканевый блок составлял порядка 20 мм) подвергали гистоморфологическому исследованию.
Результаты собственных исследований и их обсуждение
Результаты проведенных в настоящей работе исследований in vitro, при сопоставлении различных наноструктурированных МБНП (Ti-Ca-Mn-K-C-O-N и Ti-Ca-P-C-O-N), нанесенных на титановые пластины, а так же титановых пластин без покрытия, по эффектам адгезии и распластывания эмбриональных фибробластов человека на поверхности испытанных образцов свидетельствовали о том, что наноструктурированные МБНП значимо усиливают эти эффекты.
Такие же результаты были продемонстрированы в наших исследованиях in vitro в отношении ПТФЭ пластин с покрытиями. Особенностью этих экспериментов явилось, в отличие от предыдущего опыта, наличие группы полимерных образцов с покрытием Ti. У всех образцов ПТФЭ пластин с покрытиями обнаруживался выраженный эффект адгезии и распластывания культуральных клеток, в то время как у образцов без покрытия он не наблюдался.
В процессе СЭМ исследования с высоким постоянством отмечалось наличие в участках заселения поверхности образцов ПТФЭ с МБНП культуральными клетками «наплывов» гомогенного вещества, которое, по нашему мнению является экстрацеллюлярным матриксом. При этом последний не определялся на электронограммах титановых пластин даже в участках плотного адгезирования культуральных клеток. Вне тела клеток можно было видеть лишь многочисленные псевдоподии и отростки, но никак не «наплывы» биоматрикса.
Возможно, столь обильное образование экстрацеллюлярного матрикса связано с повышенной функциональной активностью клеток, оказавшихся в оптимальных для их жизнедеятельности условиях, чему могла определённо способствовать чрезвычайно развитая поверхность высокопористого ПТФЭ с наноструктурированным покрытием.
По первому разделу экспериментов in vivo в опытах на крысах были использованы 2 метода морфологического изучения области контакта имплантат – кость: метод СЭМ и гистоморфологический метод. Это обусловлено необходимостью верифицировать данные, полученные с помощью гистоморфологического метода, применение, которого, как известно, сопряжено с необходимостью извлечения металлического имплантата из костного блока до получения срезов. Естественно, применение этой методики таит в себе угрозу разрушения области контакта имплантат – кость, угрозу возникновения артефактов, и как следствие, ошибочных интерпретаций. Для повышения достоверности результатов экспериментального исследования применяли дополнительно метод СЭМ, который позволяет исследовать недекальцинированные тканевые блоки, содержащие имплантаты.
Результаты гистоморфологического исследования, СЭМ-исследования, а также проведенной непараметрической морфометрии (табл.1), свидетельствовали о том, что между характеристиками тканевых структур периимплантатной зоны и химическим составом поверхности титановых имплантатов существует прямая корреляция. Качество покрытия имплантата определяло его способность к интеграции, в том числе к остеоинтеграции. Наилучшие по признакам остеоинтеграции характеристики имплантатов были отмечены в опытах с покрытием Ti-Ca-P-C-O-N (превалирование остеоинтеграции). Наихудшие показатели интеграции наблюдались в группах с покрытием Ti-Ca-Mn-K-C-O-N (фиброостеоинтеграция) и без МБНП (фиброинтеграция).
Таблица 1
Данные полуколичественного морфометрического метода оценки развития тканевых структур в периимплантатной зоне по данным СЭМ по пятибалльной шкале
|
Критерии оценки |
10 суток |
20 суток |
30 суток | ||||||
|
Опытные группы | |||||||||
|
I |
II |
III |
I |
II |
III |
I |
II |
III | |
|
Масштабы развития волокнистых структур |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
0 |
5 |
|
Уровень зрелости волокнистых структур |
0 |
0 |
0 |
2 |
4 |
2 |
4 |
5 |
3 |
|
Наличие костных структур |
0 |
0 |
0 |
0 |
2 |
1 |
1 |
5 |
0 |
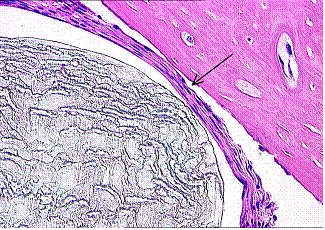
Следует отметить, что на начальных этапах и до 30 суток различия в группах наблюдения по характеристикам периимплантатных тканей были незначительными, в этой зоне преобладали реактивные изменения на экспериментальное воздействие (пропил кости), сопровождавшиеся резорбтивными реакциями кости, воспалением, и образованием клеточноволокнистой соединительной ткани, отделяющей имплантат от костной ткани (рис. 1, 2). Лишь с увеличением сроков наблюдений до 90 суток отмечалось нарастание признаков остеоинтеграции в группах МБНП, однако наиболее чётко этот тип реакции определялся в образцах с покрытием Ti-Ca-P-C-O-N.
|
|
|
|
Рис.1. Имплантат с покрытием Ti-Ca-P-С-O-N, 30 суток. Плотное спаяние кости с имплантатом на значительном протяжении. Х100. |
Рис.2. Титановый имплантат без покрытия, 30 суток. Имплантат частично вмурован в кость. В области соединения видны волокнистые структуры. Х100. |
Однако, признаки расхождения в характере реакций тканевых структур в периимплантатной зоне по группам наблюдений начинали проявляться уже, начиная с 20 суток наблюдений. Так, при сопоставлении морфологических картин в различных группах наблюдений оптимальные результаты с точки зрения интеграционного процесса были получены в опытах с имплантатами, имеющими покрытие состава Ti-Ca-P-С-O-N. В опытах с образцами этого типа наблюдалось более быстрое созревание соединительнотканной прослойки, отделяющей имплантат от материнской кости. В отличие от других групп наблюдений, в этом случае отсутствовали проявления некроза, а так же резорбтивные изменения в прилежащей к имплантату костной ткани, а так же отмечалось развитие интенсивного остеогенеза в области имплантации.
С учётом полученных данных, был спланирован ещё один эксперимент, направленный на решение вопроса о практическом значении выявленных в предыдущем эксперименте (на крысах) данных об оптимизирующем интеграцию имплантатов в кость эффекте МБНП Ti-Ca-P-С-O-N.
Результаты экспериментального исследования с установкой винтовых дентальных имплантатов с покрытием и без такового на нижней челюсти собак по данным СЭМ-исследования, через 4 месяца после установки имплантатов, у образцов без покрытия развивалась картина фиброостеоинтеграции, а у имплантатов с МБНП состава Ti-Ca-P-С-O-N - картина остеоинтеграции (рис. 3, 4). Результаты этого эксперимента убедительно свидетельствуют о том, что МБНП состава Ti-Ca-P-С-O-N следует признать перспективным для применения в дентальной имплантологии.
|
|
|
|
Рис.3. Имплантат с покрытием Ti-Ca-P-C-O-N. В области интерфейса, в непосредственном контакте с имплантатом, располагается костная ткань губчатого строения с примесями волокнистых соединительнотканных структур. Картина остеоинтеграции. Х87 |
Рис.4. Имплантат без покрытия (контроль). В области интерфейса определяется слой волокнистой ткани, отделяющий имплантат от костной ткани. Картина фиброостеоинтеграции. Х87 |
Второй раздел экспериментальных исследований был посвящён изучению интеграционного потенциала ПТФЭ с МБНП и без покрытия.
Сама идея обратиться к изучению этого материала в контексте задач настоящего исследования родилась в стремлении найти новую модель для получения информации о структурных проявлениях взаимодействий металлического имплантата с костной тканью в области их контакта.
Актуален поиск адекватных методологических подходов к изучению тонких локальных механизмов интеграционного процесса при имплантации титановых имплантатов в кость из-за невозможности изготовления в случае использования рутинных гистологических методов тонких и ультратонких срезов, что затрудняет изучение состояния тканевых структур периимплантатной зоны. Исходная идея состояла в создании «муляжа» (имитации) металлического имплантата состоящего из доступной резке на микротоме основы, в качестве которой был использован ПТФЭ, и нанопокрытия из подлежащего изучению материала (например, титана или керамики). В настоящем исследовании была изучена возможность использования ПТФЭ с наноструктурированным покрытием в качестве пластин для остеосинтеза (краниопластики).
Известно, что ПТФЭ представляет собой химически и биологически абсолютно инертный материал. По своим механическим свойствам изделия из него характеризуются как «мягкие» и комфортные для контакта с тканевыми субстратами. Изделия из ПТФЭ отличают высокая прочность и удовлетворительные трибологические показатели. Материалу присущи полное отсутствие токсичности, и соответственно, высокая биосовместимость. Всё это обусловило довольно широкое использование изделий из ПТФЭ в медицине, в том числе в стоматологии и челюстно-лицевой хирургии ( и соавт., 1999; , 2001).
В тоже время из-за гидрофобности и соответственно из-за его неспособности к остеоинтеграции ПТФЭ не нашёл широкого применения в костнопластической хирургии (например, для закрытия костных дефектов). Использование ПТФЭ с наноструктурированным МБНП открывает перспективу успешного применения указанного материала в челюстно-лицевой хирургии для вышеуказанной цели. Немаловажным является и то, что производство изделий медицинского назначения из ПТФЭ уже налажено в нашей стране фирмой «Экофлон» (СПб), включено в реестр разрешённых к клиническому применению и уже достаточно широко используется в стоматологии.
Эксперименты с имплантатами на основе ПТФЭ, как уже указывалось выше, состояли из 2 серий опытов.
Результаты первой серии опытов на крысах, впрочем, как и серия опытов на кроликах, убедительно показали, что образцы из ПТФЭ с наноструктурированными покрытиями действительно могут с успехом использоваться для изучения тканевых структур периимплантатной зоны. Более того, эта модель позволит оценить корреляцию химического состава поверхности имплантата с характером протекающих на ней (на поверхности) интеграционных процессов.
В проведенных экспериментах было подтверждено априорное предположение, что сам по себе ПТФЭ без покрытия в том виде, как он использовался в настоящей работе, не позволяет достичь высокого уровня интеграции имплантатов в костную ткань.
Было показано, что по выраженности остеоинтеграции, по отсутствию воспалительной реакции и отсутствию повреждающего воздействия на костную ткань оптимальным покрытием является наноструктурированное МБНП Ti-Ca-P-C-O-N (рис. 5). Оно сообщает имплантатам из ПТФЭ высокий остеоинтеграционный потенциал, который у этого полимера без покрытия отсутствует (рис. 6).
|
|
|
|
Рис.5. Имплантат с покрытием Ti-Ca-P-С-O-N, 30 суток. Костная ткань плотно прилегает к поверхности имплантата. Х1000 |
Рис.6. ПТФЭ имплантат без покрытия, 30 суток. Непосредственно к имплантату прилежит тонкий клеточноволокнистый тяж. Х400. |
В порядке обсуждения условий эксперимента во второй группе опытов второй экспериментальной серии следует указать на то, что у подопытных кроликов воспроизводили не просто обширные дефекты свода черепа, а критические, которые обычно самостоятельно полностью не закрываются в результате «физиологической» регенерации костной тканью.
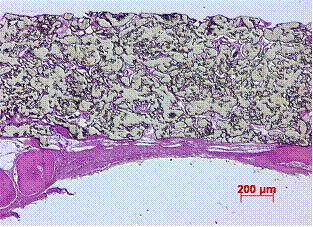
В экспериментах с высокопористыми пластинами из ПТФЭ с наноструктурированным МБНП состава Ti-Ca-P-С-O-N, было показано, что в таком виде имплантаты на основе ПТФЭ обладают высоким интеграционным потенциалом (рис. 7). Как правило, в поры имплантата происходило активное врастание новообразованного костного вещества, а так же тяжей клеточноволокнистой соединительной ткани (рис. 8). Отмечалась интенсивная регенерация костной ткани в краях дефекта, в результате чего к 6 месяцам эксперимента произошло значимое уменьшение размеров костного дефекта.
При использовании в эксперименте ПТФЭ пластин без покрытия, описанные выше эффекты, не наблюдались, отсутствовало прорастание костных структур в поры имплантата, а соединительная ткань крайне индифферентного вида не столь активно проникала в его поры.
|
|
|
|
Рис. 7. Пластина из ПТФЭ с покрытием Ti-Ca-P-С-O-N, 6 мес. В результате центростремительного продвижения костного регенерата, его размеры в плоскости гистопрепарата сократились. В дефекте под имплантатом определяется пласт фиброзной соединительной ткани. Х25. |
Рис. 8. Пластина из ПТФЭ с покрытием Ti-Ca-P-С-O-N, 6 мес. Новообразованная костная ткань в крае дефекта, в порах ПТФЭ пластины видны отдельные костные вкрапления и соединительнотканные тяжи. Х100. |
Полученные данные могут служить основательной предпосылкой для разработки и внедрения в клиническую практику нового типа имплантатов для костно-пластической черепно-челюстно-лицевой хирургии на основе ПТФЭ с наноструктурированными МБНП.
Выводы
1. В опытах in vitro с культурой кожно-мышечных фибробластов человека установлено, что наноструктурированные многофункциональные биосовместимые нерезорбируемые покрытия с химическим составом Ti-Ca-P-O-N и Ti-Ca-Mn-K-C-O-N сообщают образцам титановых пластин повышенную, по сравнению с образцами без покрытия, способность к адгезии и распластыванию эмбриональных фибробластов человека. Интенсивная адгезия и распластывание этих клеток наблюдались так же на поверхности образцов нитей и пластин из политетрафторэтилена с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями. На поверхности образцов из политетрафторэтилена без покрытий адгезия клеток, практически, отсутствовала.
2. Как показали результаты экспериментально-морфологического исследования, проведенного на крысах, образцы титановой проволоки с наноструктурированными покрытиями, имплантированные в бедренную кость подопытных животных, активно интегрируют в костную ткань, причём характер интеграции коррелировал с химическим составом покрытий. Оптимальным образом этот процесс протекал по типу остеоинтеграции и фиброостеоинтеграции при составе покрытия Ti-Ca-P-С-O-N. Наихудший эффект по показателям интеграционного потенциала был получен в опытах с образцами проволоки с покрытиями Ti-Ca-Mn-K-C-O-N и с образцами без покрытия. В этих группах опыта наблюдался эффект фиброинтеграции имплантатов.
3. В опытах на собаках с имплантацией в участки экспериментально воспроизведенной адентии нижней челюсти дентальных винтовых имплантатов фирмы «Конмет» с покрытием состава Ti-Ca-P-С-O-N и без покрытия (контроль), по данным СЭМ, в периимплантатной зоне через 4 месяца у имплантатов с наноструктурированным МБНП наблюдалось развитие процесса остеоинтеграции, а у имплантатов контрольной группы - фиброинтеграции.
4. В опытах на крысах с политетрафторэтиленовыми нитями с покрытиями, и без таковых имплантированными в бедренную кость, было показано, что покрытия состава Ti-Ca-P-C-O-N и Ti сообщают имплантатам из политетрафторэтилена высокий остеоинтеграционный потенциал, которым сам полимер не обладает.
5. В опытах на кроликах, на основании результатов гистоморфологического исследования, установлено, что при реконструкции высокопористыми политетрафторэтиленовыми пластинами с покрытием Ti-Ca-P-C-O-N критических дефектов свода черепа кроликов происходит спаяние имплантатов с костной тканью краёв костных дефектов за счет прорастания новообразованных костных структур в поры политетрафторэтилена. В сроки 6 месяцев эксперимента у кроликов отмечалось значительное уменьшение размеров дефекта, что явилось результатом активной регенерации костной ткани в области его краёв. При краниопластике политетрафторэтиленовыми пластинами без покрытия между имплантатом и костью образовывалась фиброзная прослойка, что соответствовало развитию процесса фиброинтеграции.
Практические рекомендации
1. Рекомендуется дальнейшая разработка на основе данных, полученных в настоящем исследовании, в рамках программы НИР (г/к 02.513.11.3179 и 02.523.11.3007) по наноструктурированным многофункциональным биосовместимым нерезорбируемым покрытиям Ti-Ca-P-C-O-N имплантатов и имплантационных материалов с целью повышения их эффективности и их внедрения в клиническую практику хирургической стоматологии и челюстно-лицевой хирургии.
2. Рекомендуется внедрение в клиническую практику хирургической стоматологии дентальных имплантатов с наноструктурированным многофункциональным биосовместимым нерезорбируемым покрытием состава Ti-Ca-P-C-O-N.
3. Рекомендуется внедрение в клиническую практику титановых конструкций с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями для черепно-челюстно-лицевого остеосинтеза (реконструктивные пластины, мини - и микропластины, стержни, спицы, винты и прочие фиксаторы).
4. Рекомендуется использование нового гибридного имплантационного материала на основе политетрафторэтилена с наноструктурированными многофункциональными биосовместимыми нерезорбируемыми покрытиями для устранения обширных дефектов плоских костей черепа.
5. Рекомендуется применение имплантата на основе политетрафторэтилена с металлическими нанопокрытиями для исследования морфофункциональных характеристик тканевого субстрата в области контакта поверхности внутрикостного имплантата с тканевыми структурами периимплантатной зоны посредством рутинных гистологических методов без извлечения имплантата из окружающих тканей.
Список работ, опубликованных по теме диссертации
1. , Топоркова исследования процессов интеграции имплантационных материалов в костной ткани // Всероссийское совещание «Биокерамика в медицине».- 2006.- С.88-89
2. , , Топоркова полимера с металлическими и керамическими покрытиями в качестве основы для гибридных имплантатов // Материалы симпозиума "Актуальные вопросы тканевой и клеточной трансплантологии".-2007.- С.61-63
3. Grygoryan A. S., Filonov M. R., Shtansky D. V., Selezneva I. I., Toporkova A. K. Use of metal-coated and ceramic-coated polymers as scaffolds for composite implants // Proceedings of the british-russian workshop "Stem cells: policy, research and innovations".-2007.-С.16-17
4. , , Топоркова различных по химическому составу покрытий интраоссальных титановых имплантатов на их интеграцию в кость // Российский вестник дентальной имплантологии.-2007. - №3/4.-С.10-15
5. , , Топоркова тип имплантационного материала на основе политетрафторэтилена с металлическими и керамическими покрытиями // Стоматология.- 2007.-спецвыпуск.- С.20-26
6. , , Топоркова получения имплантационного материала на основе пористого политетрафторэтилена и материал, полученный этим способом. // Патент на изобретение № 000 от 01.01.2001
7. , Топоркова интеграции имплантатов в костную ткань. М.: Техносфера.-2007.-128 с.
8. Григоpьян А. С., P., Топоркова исследование механизмов остеоинтеграции внутpиоссальных титановых имплантатов // Архив патологии.-2008.-№3.-С.36-37
9. , , Штанский -морфологическое исследование интеграции гибридного имплантационного материала в костную ткань // Стоматология.-№2.-2009.-C.8-12